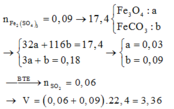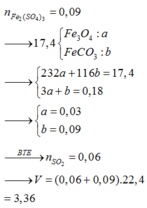hòa tan hết 23,2gam hỗn hợp X gồm FeO,Fe2O3,Fe3O4,Fe vào dung dịch chứa 0,65 mol H2SO4 (đặc nóng), sau khi kết thúc phản ứng được V(l) SO2 (đktc, sản phẩm khử duy nhất ) và dung dịch Y . Cho dung dịch Y tác dụng với 300 ml dung dịch NaOH 3M ( biết NaOH phản ứng hết ) được 21,4 gam kết tủa chỉ chứa một chất . Tính V?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

H2SO4 dùng dư đề cho rõ ràng nhé → 21,4 gam kết tủa rõ là 0,2 mol Fe(OH)3.
mà có 0,9 mol NaOH → chứng tỏ nH+ trong Y = 0,3 mol. hết.!
(p/s: đừng nhầm lẫn 0,2 mol Fe(OH)3 → ∑nFe trong X = 0,2 luôn nhé.!).
♦ CB3: 19,2 gam (Fe; O) + 0,75 mol H2SO4 (lượng đủ) → Fe2(SO4)3 + SO2 + H2O.
có 2x mol Fe → x mol Fe2(SO4)3
→ nSO2 = 0,75 – 3x theo bảo toàn S.
bảo toàn electron có 2nO trong X = 3nFe – 2nSO2
→ nO trong X = 6x – 0,75 mol
||→ mX = mFe + mO = 56 × 2x + 16 × (6x – 0,75) = 19,2
→ giải ra: x = 0,15 mol.
→ nSO2 = 0,75 – x = 0,3 mol → Yêu cầu VSO2 = 6,72 lít.
p/s: giải CB3 có khá nhiều hướng khác: ví dụ gọi x như trên thì có SO2 theo x;
nH2O = 0,375 mol → BTKL cả phương trình giải ra x luôn.!
Đáp án B

Đáp án B
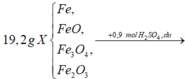
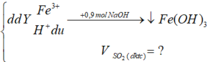
nH+ du = nNaOH - 3nFe(OH)3
=0,9 - 3.0,2 =0,3 mol
=> nH2SO4 dư = 0,3/2 = 0,15 (mol)
Coi hỗn hợp X ban đầu gồm Fe: x mol và O: y mol
Gọi nSO2 = z mol



Đáp án : B
Nếu NaOH dư => n F e O H 3 = 0,2 mol
=> nFe(bd) = 0,2 mol
=> nO(bd) = 0,5 mol. Vô lý
(Vì số mol O trong oxit cao nhất là gấp 1,5 lần số mol Fe).
Vậy NaOH thiếu : 19,2 F e : a O : b
56a + 16b = 19,2
n H 2 S O 4 = 0 , 9
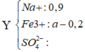
→ B T D T n S O 4 2 - = 0 , 3 + 3 a 2
→ B T N T . S n S O 2 = 0 , 9 - 0 , 3 + 3 a 2 a
6a – 2b = 1,5 ⇒ a = 0 , 3 b = 0 , 15 → V = 6 , 72

Đáp án : A
Do H2SO4 đặc dư => phản ứng tạo Fe3+
=> nkết tủa = nFe(OH)3 = 0,2 mol
Mà nNaOH = 0,9 mol > 3nFe(OH)3 => nOH trung hoà = 0,9 – 3.0,2 = 0,3 mol
=> nH2SO4 phản ứng X = 0,75 mol
Coi X gồm x mol Fe và y mol O
=> nH+ = 6nFe - 2nO = > 1,5 = 6x – 2y
, mX= 56x + 16y =19,2g
=> x = 0,3 mol ; y = 0,15 mol
=> BT e : nSO2.2 + nO.2= 3nFe => nSO2 = 0,3 mol
=> VSO2 = 6,72 lit