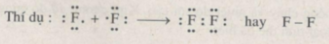2 NGUYÊN TỐ THUỘC 1 NHÓM A LIÊN TIẾP NHAU Ở 2 CHU KÌ CÁCH NHAU BAO NHIÊU NGUYÊN TỐ? VÌ SAO?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


tổng số hạt proton là 26=> ZA+ZB=26 (1)
ta có 4<26<32 =>A,B thuộc chu kì nhỏ=> ZB-ZA=8 (2)
từ 1 và 2 => ta có hệ pt
giải hệ pt ta được A=9; B=17
trong 1 nhóm từ trên xuống tính phi kim giảm => tính phi kim của A > tính phi kim của B

Tham Khảo:
A và B là hai nguyên tố ở cùng một phân nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn nên số thứ tự của chúng hơn kém nhau 8 hoặc 18 đơn vị (đúng bằng số nguyên tố trong một chu kỳ).
a,
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên (1).
Trường hợp 1:
A (Magie; chu kỳ 3, nhóm IIA); B: (Canxi; chu kỳ 4, nhóm IIA).
Trường hợp 2:
A (chu kỳ 2, nhóm VA); B: (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn

Đáp án C
Hướng dẫn ![]() . Vậy các nguyên tố thuộc chu kì 4 và 2 nguyên tố còn lại một thuộc chu kì 3 và một thuộc chu kì 5
. Vậy các nguyên tố thuộc chu kì 4 và 2 nguyên tố còn lại một thuộc chu kì 3 và một thuộc chu kì 5
Gọi Z là số proton của nguyên tố thuộc chu kì 3. Vậy nguyên tố thuộc chu kì 4 cùng nhóm A ở các chu kì 4 và 5 lần lượt là Z +8 và Z+8+18
3Z + 8+8+18 =70 → Z =12
3 nguyên tố có thứ tự lần lượt là 12, 20, 38 đó là Mg , Ca, Sr

Thật ra thì theo mình chỗ này nói là cùng 1 nhóm thì đề hợp lý hơn
\(Z_A+Z_B=18\)
2 chu kì liên tiếp nhau thì sẽ hơn kém nhau 2 hoặc 8 nguyên tố
\(\Rightarrow Z_B-Z_A=2\)
hay \(Z_B-Z_A=8\)
Thử từ trường hợp được \(Z_A=5;Z_B=13\).

Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A : 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s22s22p6 và B2+: 1s22s22p63s23p6.
Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; ZB = 25.
Cấu hình electron:
A : 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.

Các nguyên tố thuộc nhóm VIIA gồm các nguyên tố : flo (F), clo (Cl), brom (Br), iot (I), atatin (At). Nguyên tử của chúng có 7 electron hoá trị.
Khi hai nguyên tử của cùng một nguyên tố thuộc nhóm này liên kết với nhau tạo thành phân tử thì mỗi nguyên tử góp 1 electron, tạo thành một cặp electron chung tức là một liên kết, vì mỗi nguyên tử chỉ thiếu electron để đạt được cấu hình 8 electron vững bền (giống như của khí hiếm đứng sau nó).