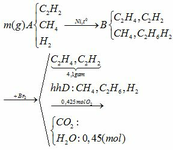
Dẫn 6,72 lít hỗn hợp khí gồm CH4 và C2H4 qua bình đựng dd Brom dư,sao cho phản ứng xảy ra hoàn toàn . Sau thí nghiệm thấy 1 chất thoát ra khỏi bình.Đốt cháy khí này rồi dẫn sản phẩm qua bình đựng dung dịch Ca(OH)2 dư, thấy tạp ra 20g kết tủa trắng.
a) Viết các phương trình hoá học xảy ra
b) Tính thành phần phần trăm theo thể tích của mỗi khí có trong hỗn hợp ban đầu.


a) C2H4 + Br2 ----> C2H4Br2 (1)
CH4 + 2O2 --to--> CO2 + 2H2O (2)
CO2 + Ca(OH)2 ----> CaCO3 + H2O (3)
b) \(n_{Khí}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
chát thoát ra sau thí nghiệm là CH4 vì CH4 ko phản ứng với Br2
\(n_{CaCO_3}=\frac{20}{100}=0,2\left(mol\right)\)
theo PTHH (2,3)
\(n_{CH_4}=n_{CO_2}=n_{CaCO_2}=0,2\left(mol\right)\)
\(\Rightarrow\%V_{CH_4}=\frac{0,2}{0,3}\cdot100=66,67\%\)
\(\Rightarrow\%V_{C_2H_4}=100\%-66,67\%=33,33\%\)
Cảm ơn bạn nhé :)))