Nguyên tử Au có bán kính và khối lượng mol nguyên tử lần lượt là 1,44Ao và 197 g/mol. Biết khối lượng riêng của Au là 19,36 g/cm3. Hỏi các nguyên tử Au chiếm bao nhiêu phần trăm thể tích trong tinh thể ?
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

18 tháng 7 2018
Theo bài ra thể tích của 1 mol Au là \(\dfrac{197}{19,36}\) (g/cm3).
Đặt x % là thể tích các nguyên tử Au trong tinh thể, thì thể tích thực của một nguyên tử Au:
V=\(\dfrac{197}{19,36}\)×\(\dfrac{x}{100.6,02.10^{23}}\)
Mặt khác với bán kính nguyên tử Au là 1,44 x 10−8 cm ta có:
V=\(\dfrac{4}{3}.3,14.\left(1,44.10^{-8}\right)^3\left(cm^3\right)\)
⇒ x = 73,95%

13 tháng 8 2016
hể tích của 1 phân tử Fe
V(Fe) = 4π/3. r˄3 = 4π/3 . (1,28.10˄-8)˄3 = 8,78.10˄-24 cm˄3
Thể tích của 1 mol Fe:
V = V(Fe).Na/74% = 8,78.10˄-24.6,022.10˄23/0,74 = 7,15cm˄3
Khối lượng riêng của Fe:
d = 56/7,15 = 7,83g/cm˄3



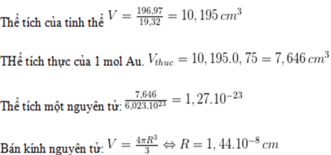
 bài giải đây nha!
bài giải đây nha!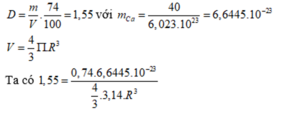
73,95 %
Theo bài ra thể tích của 1 mol Au là \(\frac{197}{19,36}\left(g/cm^3\right)\)
Đặt x % là thể tích các nguyên tử Au trong tinh thể, thì thể tích thực của một nguyên tử Au:
\(V=\frac{197}{19,36}\times\frac{x}{100\times6,02\times10^{23}}\)
Mặt khác với bán kính nguyên tử Au là 1,44 x 10−8 cm ta có:
\(V=\frac{4}{3}\times3,14\times\left(1,44\times10^{-8}\right)^3cm^3\)
⇒ x = 73,95%
Tham khảo nha !