Một oxit kim loại AxOy. Trong đó A chiếm 72,41% về khối lượng. Khử hoàn toàn oxit đó bằng CO thu đc 16,8(g) kim loại. Hòa tan hoàn toàn kim loại đó bằng dung dịch H2SO4 (loãng dư) thu đc 6,72(l) khí ở đktc. Xác định CTHH.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(M_A=\dfrac{16,8}{n_A}\left(1\right)\)
PTHH (1): \(A_xO_y+yCO\underrightarrow{t^o}xA+yCO_2\)
Bảo toàn nguyên tố A => \(m_{oxit}=16,8:72,41\%=23,2\left(g\right)\)
PTHH (2): \(2A+xH_2SO_4\rightarrow A_2\left(SO_4\right)_x+xH_2\)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT (2) ta có: \(n_A=\dfrac{0,3.2}{x}=\dfrac{0,6}{x}\left(mol\right)\left(2\right)\)
Thay (2) vào (1) ta có: \(M_A=\dfrac{16,8}{\dfrac{0,6}{x}}=28x\)
Biện luận x=1, x=2, x=3 thì ta thấy x=2 là thỏa mãn
=> \(M_A=28.2=56\left(g/mol\right)\)
=> A là Sắt (Fe)
=> CT của oxit kim loại là \(Fe_xO_y\)
=> \(n_{Fe}=\dfrac{0,6}{2}=0,3\left(mol\right)\)
=> \(n_{O\left(trong-oxit\right)}=\dfrac{23,2-16,8}{16}=0,4\left(mol\right)\)
=> \(\dfrac{x}{y}=\dfrac{0,3}{0,4}=\dfrac{3}{4}\)
=> CTHH của oxit kim loại là: \(Fe_3O_4\)

Ta có: \(n_{H_2O}=\dfrac{8,1}{18}=0,45\left(mol\right)\)
⇒ n O (trong oxit) = 0,45 (mol)
Có: m oxit = mM + mO ⇒ mM = 24 - 0,45.16 = 16,8 (g)
Giả sử kim loại M có hóa trị n khi tác dụng với H2SO4.
PT: \(2M+nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nH_2\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,6}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{16,8}{\dfrac{0,6}{n}}=28n\)
Với n = 1 ⇒ MM = 28 (loại)
Với n = 2 ⇒ MM = 56 (nhận)
Với n = 3 ⇒ MM = 84 (loại)
⇒ M là Fe. ⇒ Oxit cần tìm là FexOy.
PT: \(Fe_xO_y+yH_2\underrightarrow{t^o}xFe+yH_2O\)
Theo PT: \(n_{Fe_xO_y}=\dfrac{1}{y}n_{H_2O}=\dfrac{0,45}{y}\left(mol\right)\)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{24}{\dfrac{0,45}{y}}=\dfrac{160}{3}y\)
\(\Rightarrow56x+16y=\dfrac{160}{3}y\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy: Oxit đó là Fe2O3.
Bạn tham khảo nhé!

gọi ct oxit là R2Ox
R2Ox + xH2SO4 = R2(SO4)x + xH2O
Từ pt => \(\frac{20}{2R+16.x}\)= \(\frac{50}{2R+96x}\)=> R = \(\frac{56}{3}\)x
với x= 3 => R là Fe : CT : Fe2O3
từ đấy bạn viết pt tạo ra Fe với phản ứng hoàn toàn để tính ra số mol CO nhé


Vậy n = 3, R = 56 thỏa mãn, oxit là F e 2 O 3
n F e 2 O 3 = 20 160 = 0,125 m o l
m m u o i = m F e S O 4 + m F e 2 ( S O 4 ) 3
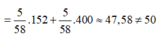
![]()
Đáp án: D

a. PTHH:
MxOy + yCO → xM + yCO2↑
2M + 6H2SO4 → M2(SO4)3 + 3SO2↑ + 6H2O
b.
2M + 6H2SO4 → M2(SO4)3 + 3SO2↑ + 6H2O
0,3 0,9 0,15 0,45 0,9
⇒MM=16,8/0,3=56 =>M là Fe.
Công thức oxit là FexOy.
Vì trong oxit kim loại Fe chiếm 72,41% khối lượng nên oxi chiếm 27,59% về khối lượng.
⇒\(\hept{\begin{cases}56x=72,41\%\left(56x+16y\right)\\16y=27,59\%\left(56x+16y\right)\end{cases}}\Rightarrow\hept{\begin{cases}x=3\\y=4\end{cases}}\)
Vậy oxit là Fe3O4.

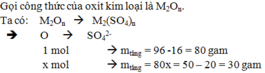
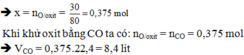
Pt AxOy +yCO \(\underrightarrow{t^o}\) xA + y CO2(1)
xA+yH2SO4 \(\underrightarrow{t^o}\) A x(SO4)y+yH2(2)
-Ta có pt 1 => nA=\(\dfrac{16.8}{A}\) (mol)(3)
theo pt B => nH2=\(\dfrac{6.72}{22.4}=0.3\left(mol\right)\) (4)
Từ 3 và 4 => \(\dfrac{16.8}{A}=0.3=>A=56\)
=> A là sắt , kí hiệu Fe
Đặt công thức hóa học của oxit kim loại là FexOy
Phần trăm oxi chiếm trong khối lượng của sắt là : 100 - 72.41=27.59%
ta có tỉ lệ x : y = \(\dfrac{\%^mFe}{^MFe}:\dfrac{\%^mO}{^MO}=\dfrac{72.41}{56}:\dfrac{27.59}{16}\approx3:4\)
Vậy công thức hóa học đơn giản là Fe3O4
BN HỌC TỐT !!!! CẦU TICK >"<
sorry!! Tick muộn:))