Để điều chế 560 g dung dịch CuSO4 16% cần phải lấy bao nhiêu gam dung dịch CuSO4 8%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{dd_{CuSO_4}}=a\left(g\right)\)
\(\Rightarrow m_{CuSO_4}=0.08a\left(g\right)\)
\(m_{CuSO_4\cdot5H_2O}=b\left(g\right)\)
\(\Rightarrow m_{CuSO_4}=\dfrac{b}{250}\cdot160=0.64b\left(g\right)\)
\(m_{dd_{CuSO_4\left(15\%\right)}}=a+b=560\left(g\right)\left(1\right)\)
\(m_{CuSO_4\left(15\%\right)}=0.08a+0.64b=560\cdot16\%=89.6\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=480,b=80\)

mCuSO4=16%.500= 80(g)
Gọi x,y là KL dd CuSO4 8% và tinh thế CuSO4.5H2O cần lấy (x>0)
m(CuSO4)= 0,08x+ 16/25y
<=>0,08x+ 0,64y= 80 (1)
Mặt khác vì KL dung dịch CuSO4 16% là 500 gam nên: x+y=500 (2)
Từ (1), (2) ta có hpt:
\(\left\{{}\begin{matrix}0,08x+0,64y=80\\x+y=500\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=\dfrac{3000}{7}\\y=\dfrac{500}{7}\end{matrix}\right.\)
Vậy để pha chế 500 gam dd CuSO4 16% thì cần 3000/7 (g) dd CuSO4 8% và 500/7 (g) tinh thể CuSO4.5H2O.

\(m_{CuSO_4}=a;m_{H_2O}=b\\ a+b=560\\ C\%_{ddsau}=\dfrac{0,28a}{560}=\dfrac{15}{100}\\ a=300;b=260\)
Vậy cần lấy 300 g dung dịch đồng(II) sulfate 28% pha với 260 g nước.

a)
Gọi $n_{CuSO_4.5H_2O} = a(mol) ; m_{dd\ H_2SO_4\ 8\%} = b(gam)$
Sau kho pha :
$m_{dd} = 250a + b = 280(1)$
$m_{CuSO4} = 160a + b.8\% = 280.15\%(2)$
Từ (1)(2) suy ra a = 0,14; b = 245(gam)
$m_{CuSO4.5H_2O} = 0,14.250 = 35(gam)$

mình không hiểu cái chỗ tính số mol CuSO4.5H2O. Bạn có thể giải thích giúp mình không

Câu 2.
Gọi \(m_{CuSO_4.5H_2O}=x\left(g\right);m_{CuSO_44\%}=y\left(g\right)\)
\(\Rightarrow x+y=500\left(1\right)\)
Khối lượng \(CuSO_4\) có trong tinh thể \(CuSO_4.5H_2O\) là:
\(m=\dfrac{x}{250}\cdot160=\dfrac{16}{25}x\left(g\right)\)
Khối lượng \(CuSO_4\) có trong \(CuSO_44\%\) là:
\(m=\dfrac{y\cdot4\%}{100\%}=\dfrac{y}{25}\left(g\right)\)
Khối lượng \(CuSO_4\) có trong \(CuSO_48\%\) là:
\(m=\dfrac{500\cdot8\%}{100\%}=40g\)
Bảo toàn cơ năng:
\(\Rightarrow\dfrac{16}{25}x+\dfrac{y}{25}=40\Rightarrow16x+y=1000\left(2\right)\)
Từ (1) và (2)\(\Rightarrow\left\{{}\begin{matrix}x=\dfrac{100}{3}\approx33,33g\\y=\dfrac{1400}{3}\approx466,67g\end{matrix}\right.\)
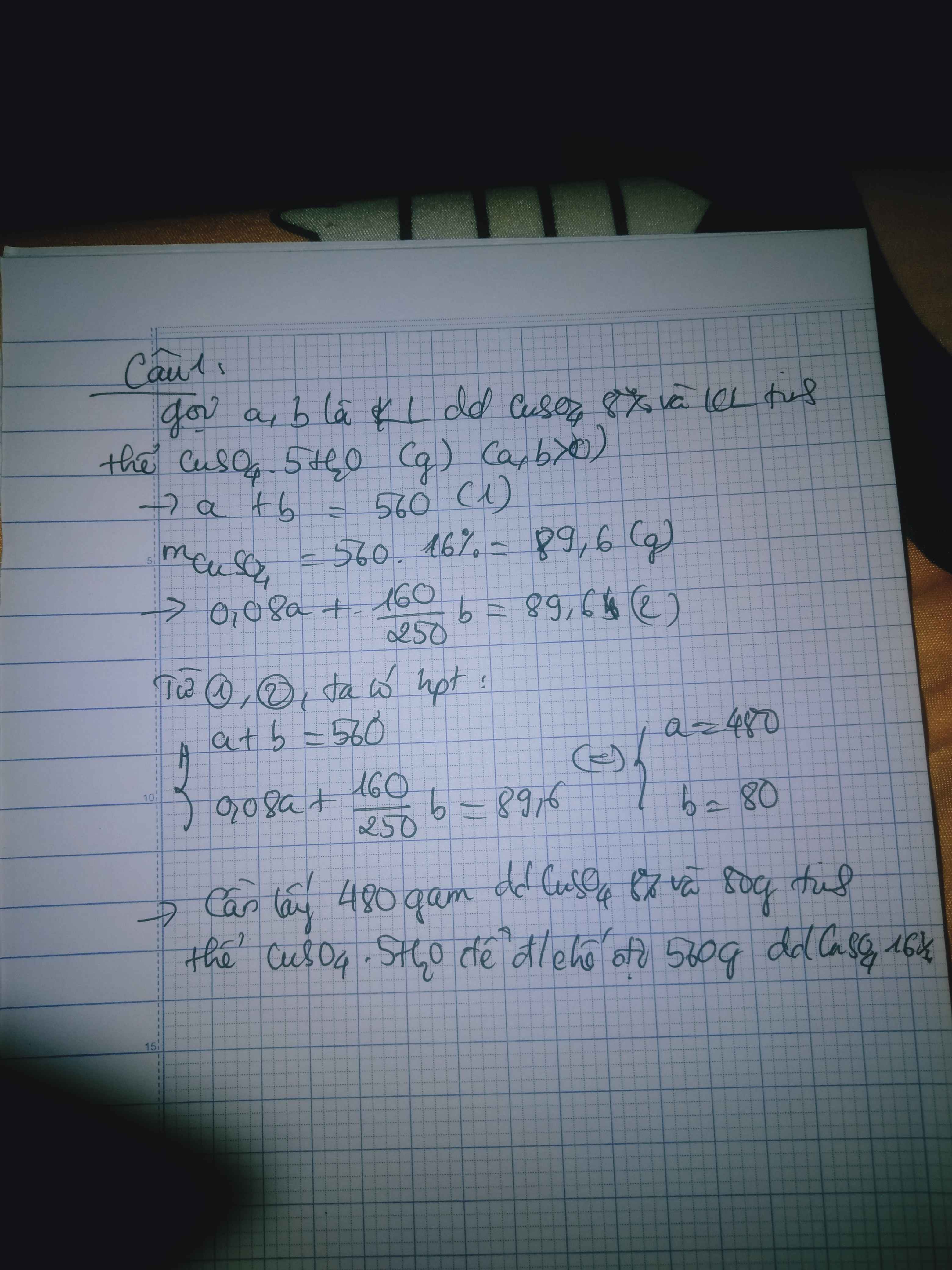

\(m_{CuSO_4}=560.16\%=89,6\left(g\right)\\ m_{ddCuSO_4\left(8\%\right)}=\dfrac{89,6}{8\%}=1120\left(g\right)\)
Anh Đạt ơi anh Đạt