dung 10 tấn quặng manhetit có chứa 69,6% fe3o4 thì có thể thu được bao nhiêu tấn gang chứa 95,2% fe, biết hiệu suất phản ứng là 93%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


%Fe = 100% -4% = 96%
$m_{Fe} = 481,25.96% = 462(gam)$
$n_{Fe} = 462 : 56 = 8,25(kmol)$
Ta có : $a + b = 1(1)$
$m_{Fe_2O_3} = 1000a.64\% = 640a(kg)$
$\to n_{Fe_2O_3} = 640a : 160 = 4a(kmol)$
$m_{Fe_3O_4} = 1000b.69,6\% = 696b(kg)$
$\to n_{Fe_3O_4} = 696b : 232 = 3b(kmol)$
Bảo toàn nguyên tố với Fe :
$4a.2 + 3b.3 = 8,25(2)$
Từ (1)(2) suy ra a = 0,75(tấn) ; b = 0,25(tấn)

\(m_{Fe_3O_4}=100000.80\%=80000(kg)\\ n_{Fe_3O_4(phản ứng)}=\dfrac{80000}{232}.93\%=320,69(kmol)\\ \Rightarrow n_{Fe}=3n_{Fe_3O_4}=962,07(kmol)\\ \Rightarrow m_{Fe}=962,07.56=53875,92(kg)\\ \Rightarrow m_{gang}=\dfrac{53875,92}{95\%}=56711,49(g)\)

m Fe3O4 = 80 tấn
=> n Fe = 1,03 (tấn mol)
=> m gang theo lý thuyết = 60,98 tấn
=> m gang thực tế = 60,98.93% = 56,71 tấn
=>D

mFe3O4 = 80%.100 = 80 tấn
Fe3O4 ------> 3Fe
--> mFe = (3.56/232).80 = 57.931 tấn
vì H = 93%
--> mFe thực tế = 57.931.93%
Gang chứa 95% Fe -
-> mgang = 100/95*57.931.93% = 56.712 tấn

38. Dùng quặng manhetit chứa 80% Fe3O4 để luyện thành 800 tấn gang có hàm lượng Fe là 95%. Quá trình sản xuất gang bị hao hụt 1%. Vậy đã dụng bao nhiêu tấn quặng?
A. 1325,3 B. 1311,9 C. 1380,5 D. 848,126.
39. Dùng quặng hematit chứa 90% Fe2O3 để sản xuất 1 tấn gang chứa 95% Fe. Hiệu suất quá trình là 80%. Khối lượng quặng hematit cần dùng là:
A. 1884,92kg B. 1880,2kg C. 1900,5kg D. 1905,5kg
40. Dùng 100 tấn quặng Fe3O4 để luyện gang (95% Fe, cho biết hàm lượng Fe3O4 trong quặng là 80%, hiệu suất quá trình là 93%. Khối lượng gang thu được là:
A. 55,8 tấn B. 56,712 tấn C. 56,2 tấn D. 60,9 tấn
Câu 38:
Phản ứng xảy ra:
\(Fe_3O_4+4CO\rightarrow3Fe+4CO_2\)
Ta có:
\(m_{Fe}=80.95\%=760\left(tan\right)\)
\(\Rightarrow m_{Fe\left(tt\right)}=\frac{760}{99\%}=767,7\left(tan\right)\)
\(\Rightarrow n_{Fe}=\frac{767,7}{56}\Rightarrow n_{Fe3O4}=\frac{n_{Fe}}{3}=\frac{2559}{560}\)
\(m_{Fe3O4}=\frac{2559}{560}.\left(56.3+16.4\right)=1060,157\left(tan\right)\)
\(\Rightarrow m_{quang}=\frac{1060,157}{80\%}=1325,19625\left(tan\right)\)
Đáp án A nhé ( Nếu bạn lấy ít số sau thì sẽ ra kết quả như vậy , đây mình lần 3 số )
Câu 39:
Phản ứng xảy ra:
\(Fe_2O_3+3CO\rightarrow2Fe+3CO_2\)
\(m_{Fe}=1.95\%=0,65\left(tan\right)\)
\(\Rightarrow m_{Fe\left(lt.tao.ra\right)}=\frac{0,95}{80\%}=1,19875\left(tan\right)\)
\(\Rightarrow n_{Fe\left(lt\right)}=\frac{1,1875}{56}\)
\(\Rightarrow n_{Fe2O3}=\frac{1}{2}n_{Fe}=\frac{1,1875}{112}\)
\(m_{Fe2O3}=\frac{1,1875}{112}.\left(56.2+16.3\right)=\frac{95}{56}\left(tan\right)\)
\(\Rightarrow m_{quang}=\frac{\frac{95}{56}}{90\%}=1,885\left(tan\right)\)
P/s :Mình làm tròn số ( đáp án A nhé )
Câu 40:
\(m_{Fe3O4}=100.80\%=80\left(tan\right)\)
Trong 232 g Fe3O4 có 168 tấn Fe (do Fe chiếm 95%)
=> 80 tấn Fe3O4\(\Rightarrow\frac{168.80}{232}=57,931\left(tan\right)\)
Khối lượng Fe để luyện gang là \(57,931.93\%=53,876\left(tan\right)\)
Khối lượng gang thu được là :\(53,876.95\%=56,712\left(g\right)\)



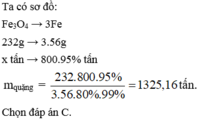
mFe3O4 = \(\dfrac{69,6}{100}\).10 = 6,96 ( tấn)
nFe3O4 = \(\dfrac{6,96}{232}\) = 0,03 mol
Fe3O4 + 4CO \(^{to}\rightarrow\)3Fe + 4CO2 \(\uparrow\)
0,03---------------->0,09
\(\Rightarrow\)mFe= 0,09 . 56 = 5,04 ( tấn)
\(\Rightarrow\)mgang(LT) = 5,04 . \(\dfrac{100}{95,2}\) = 5,3 ( tấn)
mà hiệu suất phản ứng là 93%
\(\Rightarrow\)mgang(TT) = 5,3 . \(\dfrac{93}{100}\) = 4,77 ( tấn)
số mol fe bạn tính sai rồi
phải đổi 6,96 tấn về gam rồi mới chia cho 232