Hòa tan hoàn toàn m gam hỗn hợp gồm Na, Na2O, NaOH, Na2CO3 trong lượng vừa đủ dung dịch H2SO4 40%, thu được 8,69 lít hỗn hợp khí (đktc) có tỉ khối so với H2 là 16,75 và dung dịch Y có nồng độ 51,449%. Cô cạn dung dịch Y thu được 170,4 gam muối khan. Tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Các phương trình phản ứng :
Phương trình phản ứng :
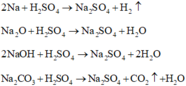
Hỗn hợp khí H2 và CO2
Dung dịch Y chỉ có Na2SO4 =>muối thu được khi cô cạn dung dịch Y là Na2SO4
Tinh toán:
Muối thu được là Na2SO4

Sơ đồ phản ứng :
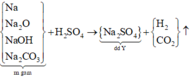
Bảo toàn gốc SO4 ta có :
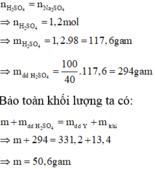

Hỗn hợp khí là H2 và CO2
Ta có a+b = 0.4 và (2a + 44b)/ 0.4 = 33.5
=> a=0.1 , b=0.3 . Muối thu đc là Na2SO4 = 1.2 mol = n H2SO4
mdd sau = 331.2 g, mdd H2SO4 =
294g
=> m hh = mddsau + mH2 + m CO2 - m ddH2SO4 = 50.6 g => Đáp án B

Y chứa Na2SO4 (1,2 mol) —> nH2SO4 = 1,2 mol
—> mddH2SO4 = 1,2.98/40% = 294 gam
mddY = 170,4/51,449% = 331,2 gam
m khí = 0,4.2.16,75 = 13,4
Bảo toàn khối lượng:
m + mddH2SO4 = mddY + m khí
—>m =50,6 gam
Đáp án C

Đáp án : D
Hỗn hợp khí gồm : H2 và CO2 có : n = 0,4 mol và M = 33,5g
=> mhh = 13,4g
Vì phản ứng vừa đủ => muối sau phản ứng chỉ có Na2SO4
⇒ n N a 2 S O 4 = n H 2 S O 4 = 1 , 2 m o l
=> mdd sau = 331,2g
m d d H 2 S O 4 = 294 g
Bảo toàn khối lượng :
m + m d d H 2 S O 4 = m d d s a u + m k h í
=> m = 50,6g
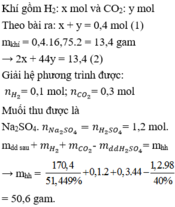
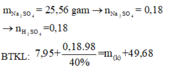
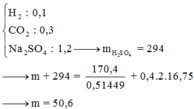
Hỗn hợp khí là H2 và CO2
 mdd sau=331,2 g; mdd H2SO4=294 gmdd sau=331,2 g; mdd H2SO4=294 g
mdd sau=331,2 g; mdd H2SO4=294 gmdd sau=331,2 g; mdd H2SO4=294 g
Ta có a+b=0,4a+b=0,4 và (2a+44b)0,4=33,5(2a+44b)0,4=33,5
⇒a=0,1;b=0,3⇒a=0,1;b=0,3. Muối thu đc là Na2SO4=1,2mol=nH2SO4Na2SO4=1,2mol=nH2SO4
⇒mhh=mddsau+mH2+mCO2−mddH2SO4=50,6g