Cho 122,5g dung dịch H2SO4 40% tác dụng hết CuO . Tính khối lượng muối thu được và khối lượng CuO
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{CuO}=\dfrac{16}{80}=0,2mol\)
PTHH: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
Theo PTHH: \(n_{H2}so_4=^nCuO=0,2mol\)
\(\rightarrow m_{H_2SO_4}=0,2.98=19,6g\)
\(+)^mddH_2SO_4=\dfrac{^mH_2SO_4}{C\%}.100=196g\)
Đến đây thì bn bt lm chx ạ?

\(nCuO=\dfrac{8}{80}=0,1\left(mol\right)\)
\(nH_2SO_4=\dfrac{19,6}{98}=0,2\left(mol\right)\)
\(LTL:\dfrac{0,1}{1}< \dfrac{0,2}{1}\)
=> CuO pứ đủ , H2SO4 dư
CuO+H2SO4 -> CuSO4+H2O
0,1 0,1 0,1 0,1
\(nH_2SO_{4\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
\(mH_2SO_{4\left(dư\right)}=0,1.98=9,8\left(g\right)\)
c1:
\(m\left(muối\right)=mCuSO_4=0,1.160=16\left(g\right)\)
c2:
\(mH_2O=0,1.18=1,8\left(g\right)\)
BTKL:
mCuO+mH2SO4 = m CuSO4+ mH2O
8 + (19,6-9,8) = m CuSO4 + 1, 8
=> mCuSO4 = 8 + ( 19,6 - 9,8 ) - 1,8 = 16 (g)

a) Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{SO_2}=n_{Cu}=0,2\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)
\(\%m_{Cu}=\dfrac{12,8}{20,8}.100=61,54\%\); \(\%m_{CuO}=38,46\%\)
b) \(n_{CuO}=\dfrac{20,8-12,8}{80}=0,1\left(mol\right)\)
\(n_{H_2SO_4}=0,2.2+0,1=0,5\left(mol\right)\)
\(m_{ddH_2SO_4}=\dfrac{0,5.98}{80\%}=61,25\left(g\right)\)
\(n_{CuSO_4}=0,2+0,1=0,3\left(mol\right)\)
\(m_{CuSO_4}=0,3.160=48\left(g\right)\)

nH2 = 1.12/22.4 = 0.05 (mol)
Fe + H2SO4 => FeSO4 + H2
0.05......................0.05......0.05
mCuO = 14.8 - 0.05 * 56 = 12 (g)
%CuO = 12/14.8 * 100% = 81.08%
nCuO = 12 / 80 = 0.15 (mol)
CuO + H2SO4 => CuSO4 + H2O
0.15..........................0.15
mFeSO4 = 0.05 * 152 = 7.6 (g)
mCuSO4 = 160 * 0.15 = 24 (g)
nH2 = 1.12/22.4 = 0.05 (mol)
Fe + H2SO4 => FeSO4 + H2
0.05......................0.05......0.05
mCuO = 14.8 - 0.05 * 56 = 12 (g)
%CuO = 12/14.8 * 100% = 81.08%
nCuO = 12 / 80 = 0.15 (mol)
CuO + H2SO4 => CuSO4 + H2O
0.15..........................0.15
mFeSO4 = 0.05 * 152 = 7.6 (g)
mCuSO4 = 160 * 0.15 = 24 (g)

a)
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
$n_{CuO} = \dfrac{8}{80} = 0,1 < n_{H_2SO_4} = 0,2.1 = 0,2$ nên $H_2SO_4$ dư
Theo PTHH : $n_{CuSO_4} = n_{CuO} = 0,1(mol)$
$m_{CuSO_4} = 0,1.160 = 16(gam)$
b)
$n_{H_2SO_4\ dư} = 0,2 - 0,1 = 0,1(mol)$
$C_{M_{H_2SO_4\ dư}} = \dfrac{0,1}{0,2} = 0,5M$
$C_{M_{CuSO_4}} = \dfrac{0,1}{0,2} = 0,5M$

\(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\\n_{Fe_2O_3}=c\left(mol\right)\\n_{CuO}=d\left(mol\right)\end{matrix}\right.\)⇒ 56a + 64b + 160c + 80d = 12,4(1)
BT e : \(2n_{SO_2} = 3n_{Fe} + 2n_{Cu}\)
⇒ 3a + 2b = \(2. \dfrac{2,8}{22,4} = 0,25\) ⇔ 8(3a + 2b) = 0,25.8 ⇔ 24a + 16b = 2(2)
Lấy (1) + (2),ta có :
80a + 80b + 160c + 80d = 12,4 + 2 = 14,4
Bảo toàn nguyên tố với Fe,Cu
2Fe → Fe2O3
a..............0,5a.........(mol)
Cu → CuO
b............b...............(mol)
Fe2O3 → Fe2O3
c....................c...............(mol)
CuO → CuO
d...................d................(mol)
Vậy :
\(m_Z = m_{Fe_2O_3} + m_{CuO} = 160(0,5a + c) + 80(b+d)\\ = 80a + 80b + 160c + 80d \\= 14,4(gam)\)

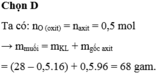
PTHH: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
Ta có: \(n_{H_2sO_4}=\dfrac{122,5\cdot40\%}{98}=0,5\left(mol\right)=n_{CuO}=n_{CuSO_4}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{CuSO_4}=0,5\cdot160=80\left(g\right)\\m_{CuO}=0,5\cdot80=40\left(g\right)\end{matrix}\right.\)