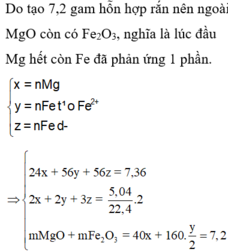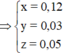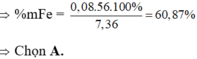Hòa tan m g hỗn hợp Fe Cu Mg vào dung dịch H2SO4 đặc nóng dư thu được dung dịch A và khí SO2 dung dịch A tác dụng với NaOH dư tại kết tủa .Nung kết tủa đến khối lượng không đổi được a g chất rắn Biết A chưa m và 67,2g hỗn hợp 3 muối sunfat .Tính a theo m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Fe + 6H2SO4 đ,n--> Fe2(SO4)3 + 6H2O +3 SO2
Cu+ 2H2SO4đ, n--> CuSO4 + 2H2O + SO2
Mg+ H2SO4đ,n--> MgSO4 + H2O + SO2
So2 + 2NaOH--> Na2SO3 + H2O
Fe2(SO4)3 + 6NaOH--> 2Fe(OH)3 + 3Na2SO4
CuSO4 + 2NaOH--> Cu(OH)2 + Na2SO4
MgSO4 + 2NaOH---> Na2SO4 + Mg(OH)2
2Fe(OH)3--> Fe2O3 + 3H2O
Cu(OH)2--> CuO + H2O
Mg(OH)2--> MgO + H2O
mình không hiểu ở chỗ đề A chứa m và 67,2 g hh 3 muối cho lắm
Đề bài nó ghi thế tớ cũng không hiểu lắm thế nên mới phải đi hỏi

Đáp án C

- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+
=> T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36)
=> Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước)
=> kết tủa Y gồm Cu, Ag, Fe.
- Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1)
- Bảo toàn e cho phản ứng trao đổi muối: 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b
- Khi Y + H2SO4 đặc nóng (Fe → Fe3+)
Bảo toàn electron: 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol
=> 2a + 2b + 3c = 0,45 (2)
- Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3.
Bảo toàn nguyên tố: nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b
=> mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3)
Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol
=> mFe(X) = 56.(0,03 + 0,05) = 4,48g
=> %mFe(X) = 4,48: 7,36 = 60,87%

Hòa tan bằng H2SO4 => Cu không tác dụng
Cho tác dụng NaOH dư chỉ còn lại kết tủa của Fe
Nung hidoxit của Fe trong không khí => thu được Fe2O3 => Đap an D

Đáp án : A
Fe;Fe2O3 -> FeCl2;FeCl3 -> Fe(OH)2;Fe(OH)3 -> Fe2O3
Bảo toàn Fe : 2nFe2O3 sau = nFe + 2nFe2O3 ban đầu
=> nFe2O3 sau = 0,2 mol
=> m = 32g

CT chung A+2nH2SO4-->A2(SO4)n+nSO2+2nH2O
0.035/n 0.035 (mol)
A2(SO4)n-->A2On
0.035/n 0.035/n
mr=mA+(0.035/n)*n*16=2g
trắc nghiệm nSO42-=nSO2=0.035
BTĐT( chất rắn nên tự luận ko ghi được):nO2-=nSO42-=0.035
mr=mA+mO2-=2
A+2nH2SO4-->A2(SO4)n+nSO2+2nH2O
0.035/n 0.035 (mol)
A2(SO4)n-->A2On
0.035/n 0.035/n
mr=mA+(0.035/n)*n*16=2g
trắc nghiệm nSO42-=nSO2=0.035
BTĐT( chất rắn nên tự luận ko ghi được):nO2-=nSO42-=0.035
mr=mA+mO2-=2
#GG

Đáp án C
Có mhỗn hợp rắn < mFe => Chứng tỏ X chưa tan hết.
=> Fe bị oxi hóa lên Fe(II)
Đặt số mol Fe phản ứng và Fe dư lần lượt là x, y.
24 . n Mg + 56 . m Fe = 7 , 36 g → BTe 2 . n Mg + 2 x + 3 y = 2 . n SO 2 = 2 . 5 , 04 22 , 4 = 0 , 45 mol m MgO + m Fe 2 O 3 = 40 . n Mg + 160 . x 2 = 7 , 2 g ⇒ n Mg = 0 , 12 mol x = 0 , 03 y = 0 , 05
⇒ % m Fe ( X ) = 56 . ( x + y ) 7 , 36 . 100 % = 60 , 87 %