Cho 4.2g muối cacbonat của kim loại hóa trị II. Hòa tan hết vào dung dịch HCl dư có khí thoát ra. Cho toàn bộ lượng khí hấp thụ vào 100ml dung dịch Ba(OH)2 0.46M thu được 8.24g kết tủa. Tìm công thức của muối và kim loại
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Vì chưa biết lương Ba(OH)2 dư hay thiếu => có 2 trường hợp
* TH1: khi Ba(OH)2 dư, tính theo lượng kết tủa
Gọi công thức muối là MCO3
CO2 + Ba(OH)2 → BaCO3 + H2O
0,042 0,042
MCO3 +2 HCl → MCl2 + CO2 + H2O
0,042 0,042
Mmuối = M+ 60 = 4,2/0,042=100 => M = 40 (Ca)
* TH2: khi Ba(OH)2 thiếu , Ba(OH)2 hết, 1 phẩn kết tủa bị hòa tan
CO2 + Ba(OH)2 → BaCO3 + H2O
0,046 0,046
nkết tủa bị hòa tan = 0,046- 0,042=0,004
BaCO3 + CO2 + H2O → Ba(HCO3)2
0,004 0,004
=> nCO2 = 0,004+ 0,0046=0,05
MCO3 +2 HCl → MCl2 + CO2 + H2O
0,05 0,05
Mmuối = M+ 60 = 4,2/0,05 = 84 => M = 24 (Mg)
Chú ý: Xét 2 trường hợp

Giả sử kim loại hóa trị II là A.
Ta có: nBa(OH)2 = 0,1 (mol)
nBaCO3 = 0,05 (mol)
\(ACO_3\underrightarrow{t^o}AO+CO_2\)
- TH1: Ba(OH)2 dư.
PT: \(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
Theo PT: \(n_{ACO_3}=n_{CO_2}=n_{BaCO_3}=0,05\left(mol\right)\)
\(\Rightarrow M_{ACO_3}=\dfrac{15}{0,05}=300\left(g/mol\right)\Rightarrow M_A=240\left(g/mol\right)\)
→ Không có chất nào thỏa mãn.
- TH2: Ba(OH)2 hết.
PT: \(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\)
______0,05_____0,05_____0,05 (mol)
\(Ba\left(OH\right)_2+2CO_2\rightarrow Ba\left(HCO_3\right)_2\)
___0,05_____0,1 (mol)
⇒ nCO2 = 0,05 + 0,1 = 0,15 (mol)
Theo PT: \(n_{ACO_3}=n_{CO_2}=0,15\left(mol\right)\Rightarrow M_A=\dfrac{15}{0,15}=100\left(g/mol\right)\)
\(\Rightarrow M_A=40\left(g/mol\right)\)
→ A là Ca.
Vậy: CTHH cần tìm là CaCO3

Đặt CT muối \(RCO_3\)
\(RCO_3\rightarrow\left(t^o\right)RO+CO_2\) (1)
\(n_{Ba\left(OH\right)_2}=15.0,01=0,15\left(mol\right)\)
\(n_{BaCO_3}=\dfrac{19,7}{197}=0,1\left(mol\right)\)
`@`TH1: Chỉ tạo ra kết tủa
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3\downarrow+H_2O\)
0,1 0,1 0,1 ( mol )
Theo ptr (1) \(n_{RCO_3}=n_{CO_2}=0,1\left(mol\right)\)
\(M_{RCO_3}=\dfrac{20}{0,1}=200\) \((g/mol)\)
\(\Leftrightarrow R=140\) \((g/mol)\) (loại )
`@`TH2: Tạo ra 2 muối
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3\downarrow+H_2O\)
0,15 ( mol )
0,1 0,1 0,1 ( mol )
\(Ba\left(OH\right)_2+2CO_2\rightarrow Ba\left(HCO_3\right)_2\)
0,05 0,1 ( mol )
Theo ptr (1): \(n_{RCO_3}=n_{RO}=0,1+0,1=0,2\left(mol\right)\)
\(M_{RCO_3}=\dfrac{20}{0,2}=100\) \((g/mol)\)
\(\Leftrightarrow R=40\) \((g/mol)\) `->` R là Canxi ( Ca )
\(m_{CaO}=0,2\left(40+16\right)=11,2\left(g\right)\)

Đáp án B
7,2 gam MCO3 + HCl → CO2 + 0,09 mol Ba(OH)2 → 0,08 mol BaCO3↓
• CO2 + Ba(OH)2 → BaCO3↓ + H2O(*)
BaCO3 + CO2 + H2O → Ba(HCO3)2 (**)
Theo (*) nCO2(*) = 0,09 mol; nBaCO3 (*) = 0,09 mol
Theo (**) nBaCO3 (**) dư = 0,08 mol → nBaCO3 (**) phản ứng = 0,09 - 0,08 = 0,01 mol
→ nCO2 (**) = 0,01 mol → ∑nCO2 = 0,1 mol
• MCO3 + 2HCl → MCl2 + CO2 + H2O
nMCO3 = nCO2 = 0,1 mol → MMCO3 = 7,2 : 0,1 = 72 → MM = 12 → Be và Mg (9 < 20 < 24)
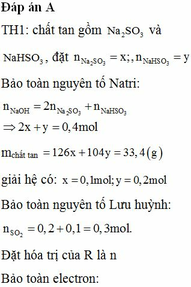

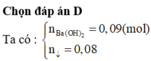

n Ba(OH)2