1)Đặt 2 cốc A và B có m = nhau lên 2 đĩa cân thì cân thăng bằng.Cho 10,6 g Na2CO3 vao cốc A và 11,82 g BaCO3 vào cốc B.Sau đó thêm 12g dung dịch H2SO4 98% vào cốc A cân mất thăng bằng.Nếu thêm từ từ dung dịch HCl 14,6% vào cốc B cho tới khi cân trở lại thăng bằng thì tốn hết bao nhiêu g dung dịch HCl ( giả sử nước và axit k bay hơi )
2)Khi can thăng bằng lấy 1\2 lượng các chất trong cốc B cho vào cốc A cân mất thăng bằng
a)Phải thêm vào bao nhiêu g nước vào cốc B để cân trở lại thăng bằng
b)Nếu k dùng nước mà dùng dung dịch HCl 14,6% thì phải thêm bao nhiêu g dung dịch HCl
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình phản ứng trong cốc A:
Na2CO3 + H2SO4 -> Na2SO4 + H2O + CO2
Phương trình phản ứng trong cốc B:
BaCO3 + HCl -> BaCl2 + H2O + CO2
Ta có thể tính khối lượng của BaCO3 và Na2CO3 như sau:
Khối lượng BaCO3 = 11,82g
Khối lượng Na2CO3 = 10,6g
Để tính khối lượng dung dịch HCl cần thêm vào B, ta sử dụng quy tắc tỉ lệ:
(11,82g BaCO3) : (14,6% HCl) = (m gam BaCO3) : (100% HCl)
Từ đó, ta tính được m gam HCl cần thêm vào B:
m = (11,82g BaCO3) x (100% HCl) / (14,6% HCl) ≈ 80,82g
Vậy giá trị của m là khoảng 80,82 gam.

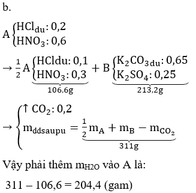
a.
|
|
AgNO3 |
K2CO3 |
| Ban đầu |
0,6 mol; 102 gam |
0,9 mol; 124,2 gam |
| Thêm vào |
→ HCl : 0 , 1 mol ↓ AgCl : 0 , 6 mol |
← H 2 SO 4 : 0 , 25 ↑ CO 2 : 0 , 25 |
| Sau phản ứng |
115,9gam |
213,2 gam |
| Thêm nước |
213,2 – 115,9 = 97,3 gam |
|

nMg=3,6/24=0,15 mol ; nAl=5,4/27=0,2 mol
1) Mg + 2HCl --> MgCl2 + H2 (1)
0,15 0,15 0,15 mol
2Al+ 3H2SO4 --> Al2(SO4)3 + 3H2 (2)
0,2 0,1 0,3 mol
b)(1) => vH2=0,15x22,4=3,36 l
(2) => V H2= 0,3x22,4=6,72 l
=> VH2(2) > VH2(1)
c) đặt dd HCl là A => dd H2SO4 = A
(1) => m dd sau = 0,15*24 + A -0,15 *2 =3,3 + A
(2) => m dd sau= 0,2*27 + A - 0,2 *2=4,8+A
=> cần thêm nước vào cốc thứ nhất và thêm số gam là
4,8 + A - (3,3 + A) = 1,5 g nước

\(n_{Fe}=\dfrac{7,84}{56}=0,14\left(mol\right);n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,14 0,14
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
'Mol: 0,3 0,45
⇒ Khối lượng đc thêm vào ở cốc A là 7,84-0,14.2=7,56 (g)
Khối lượng đc thêm vào ở cốc B là 8,1-0,45.2=7,2 (g)
⇒ Cốc A nặng hơn cốc B (do khối lượng axit được lấy vào 2 cốc bằng nhau )
Vậy cân ko còn ở vị trí thăng bằng

Dự đoán: Kim của cân nghiêng về phía quả cân
Giải thích: Vì do có sự thất thoát CO2 bay ra ngoài nên khối lượng bên đĩa cân A bị giảm đi nhỏ hơn so với đĩa cân B
`Na_2CO_3 + 2HCl -> 2NaCl +CO_2 + H_2O`

- Cốc A: \(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
\(n_{CaCO_3}=\dfrac{25}{100}=0,25\left(mol\right)=n_{CO_2}\)
Có: m cốc A tăng = mCaCO3 - mCO2 = 25 - 0,25.44 = 14 (g) = m cốc B tăng
- Cốc B: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
GọI: nAl = x (mol) \(\Rightarrow n_{H_2}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}x\left(mol\right)\)
Có: m cốc B tăng = 14 (g) = 27x - 3/2x.2
⇒ x = 7/15 (mol)
\(\Rightarrow a=m_{Al}=\dfrac{7}{15}.27=12,6\left(g\right)\)

PTHH


Để cân thăng bằng thì lượng khí H2 sinh ra ở 2 phản ứng trên là như nhau.
Vì ![]() và lượng H2 sinh ra ở 2 phản ứng trên phụ thuộc vào HCl là như nhau.
và lượng H2 sinh ra ở 2 phản ứng trên phụ thuộc vào HCl là như nhau.
Để cân thăng bằng thì lượng HCl cho vào không vượt quá lượng tối đa để hoà tan hết Fe
Theo PTHH (1):
![]()
![]()
mọi người ơi giúp em vs ạ :((((
Bài 1 : nNa2CO3 = 0,1 mol ; nBaCO3 = 0,06mol ; nH2SO4 = 0,12mol
Na2CO3 + H2SO4 -> Na2SO4 + H2O + CO2
0,1 0,1 0,1 (mol)
nH2SO4 dư = 0,12 - 0,1 = 0,02 mol
mA = m + mNa2CO3 + mddH2SO4 - mCO2 = 18,2 + m
mB = m + mBaCO3 11,82 + m
=> mA - mB = 6,38
gọi m dd HCl = a
=> nHCl ( a x 14,6%)/ 36,5 = 0,04a
BaCO3 + 2HCl -> BaCl2 + H2O + CO2
0,002a 0,004a 0,002a 0,002a 0,002a (mol)
mCO2 = 0,002a x 44 = 0,088a
=> 6,38 = a-0,088a
=> a = 7