Hòa tan một lượng sắt vào 400 ml dung dịch HCl vừa đủ Sau phản ứng thu được 3,36 lít khí hidro nồng độ M của dung dịch HCl là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{3,7185}{24,79}=0,15(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow n_{HCl}=2n_{H_2}=0,3(mol)\\ \Rightarrow C_{M_{HCl}}=\dfrac{0,3}{0,4}=0,75M\)

Câu 4:
Tính khối lượng của H2SO4 có trong dung dịch:
m = n x M x V
Trong đó:
n = 0,4 mol (số mol của H2SO4)
M = 98g/mol (khối lượng mol của H2SO4)
V = 200g (thể tích của dung dịch)
m = 0,4 mol x 98g/mol x 200g / 1000g = 7,84g
% = (khối lượng H2SO4 / khối lượng dung dịch) x 100 % = (7,84g / 200g) x 100 = 3,92% Vậy nồng độ % của dung dịch axít đã phản ứng là 3,92%.
C6
Mg + 2HCl -> MgCl2 + H2
m = n x M
n = m / M
Trong đó:
m = 9,6g (khối lượng của Mg)
M = 24,31g/mol (khối lượng mol của Mg)
n = 9,6g / 24,31g/mol = 0,395 mol
Mg + 2HCl -> MgCl2 + H2
Tỷ lệ phản ứng của Mg và HCl là 1:2, vì vậy số mol của HCl là 2 x 0,395 mol = 0,79 mol.
Để tính khối lượng của dung dịch sau phản ứng, ta cần biết khối lượng riêng của dung dịch HCl. Với dung dịch HCl có nồng độ 36,5%, khối lượng riêng xấp xỉ là 1,18 g/mL.
V = m / rho
V = 120g / 1,18 g/mL = 101,69 mL (thể tích của dung dịch)
m (HCl) = 0,79 mol x 36,5g/mol = 28,835 g (khối lượng của HCl sau phản ứng)
M (dung dịch sau phản ứng) = m + M(H2O) = 28,835g + 72g = 100,835g
% = (khối lượng chất tan / khối lượng dung dịch) x 100
% = (28,835g / 100,835g) x 100 = 28,62%
Vậy nồng độ phần trăm của dung dịch sau phản ứng là 28,62%.

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{ZnCl_2}=n_{Zn}=n_{H_2}=0,15\left(mol\right);n_{HCl}=2.0,15=0,3\left(mol\right)\\ a,m=m_{Zn}=0,15.65=9,75\left(g\right)\\ b,C_{MddHCl}=\dfrac{0,3}{0,15}=0,2\left(l\right)\\ c,m_{ZnCl_2}=0,15.136=20,4\left(g\right)\)

\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:\(2Fe+6HCl\rightarrow2FeCl_3+3H_2\)
0,1 0,4 0,1 0,2
\(CM_{HCl}=\dfrac{n_{ct}}{V_{dd}}=\dfrac{0,4}{0,5}\)=0,8(M)

a) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
____0,15<--0,3<-------------0,15
=> mFe = 0,15.56 = 8,4 (g)
b) \(C_{M\left(ddHCl\right)}=\dfrac{0,3}{0,05}=6M\)

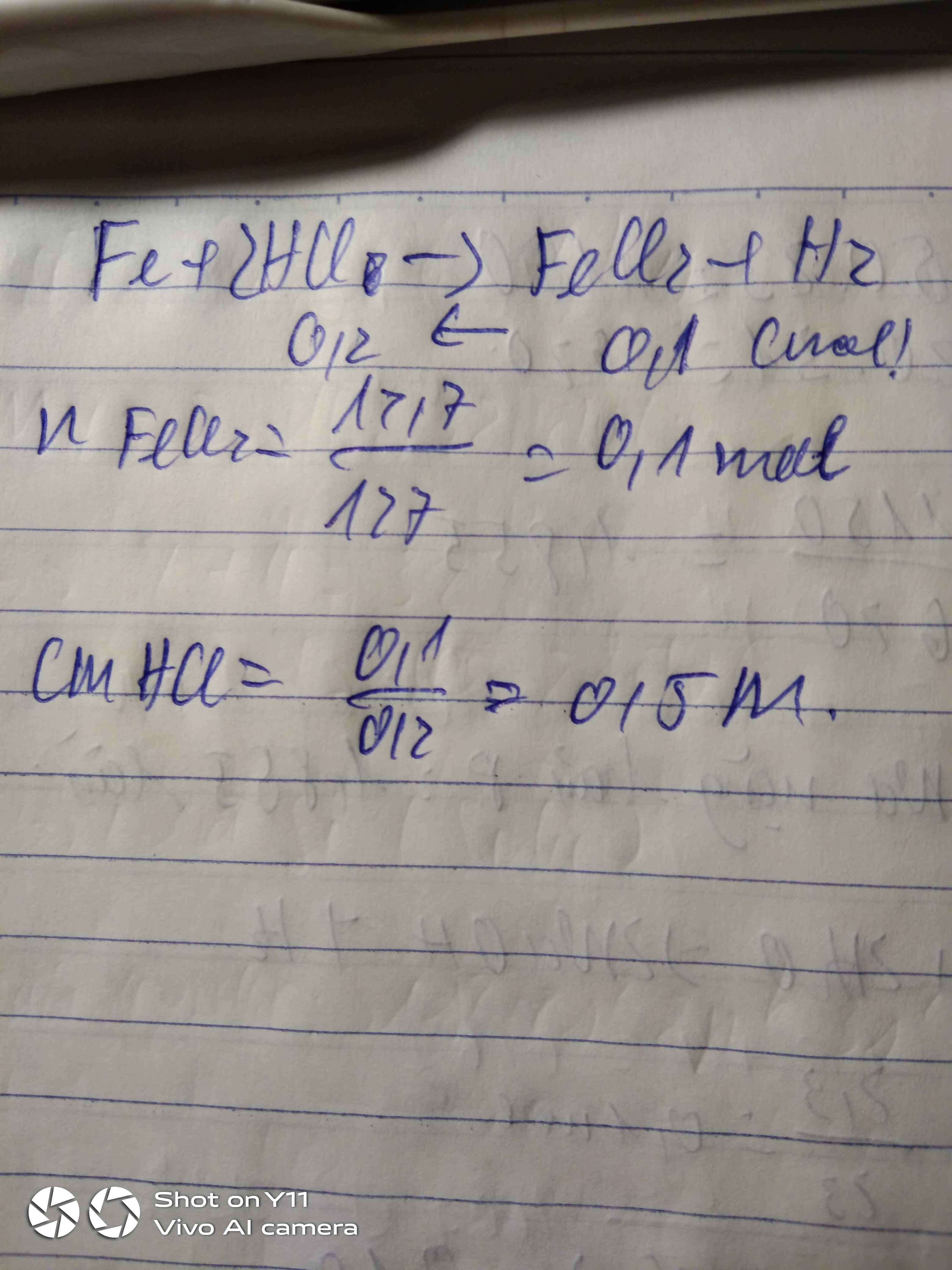

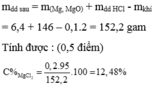
ĐỔI: 400ml= 0,4 l
nkhí H2= 3,36:22,4=0,15 mol
Fe+ 2HCl ----> FeCl2+H2
0,15 0,3 <---------------0,15
=> CM(HCl)= n:V=0,3 : 0,4 = 0,75 M