Cho 19,3g hỗn hợp bột gồm Zn và Cu có tỉ lệ mol tương ứng là 1:2 vào dd chứa 0,2 mol Fe2(SO4)3. Sau khi các pư xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Đặt nZn = x mol ; nCu =2x mol
=> m hỗn hợp = 65x +64.2x =19,3 g => x = 0,1 mol
Có nFe3+ = 0,4 mol ,Xảy ra các quá trình sau:
Zn + 2Fe3+ → Zn 2+ + 2Fe2+
Mol 0,1 -> 0,2
Cu +2 Fe3+ → Cu 2+ + 2Fe2+ Mol 0,1 <- 0,2
=> m = mCu dư = 0,1 .64 = 6,4g

Đặt nZn = x (mol) và nCu = 2x (mol)
(Vì hỗn hợp bột gồm Zn và Cu có tỉ lệ về số mol là 1:2)
⇒ mhỗn hợp = mZn + mCu
= 65x + 64 × 2x) = 19,3 g
⇒ x = 0,1 mol
Có nFe3+ = 0,4 mol. Xảy ra các quá trình sau:
PTHH: Zn + 2Fe3+ → Zn2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: 0,1 → ?(mol)
=>nFe3+ = 0,1.2110,1.2 = 0,2(mol)
PTHH: Cu + 2Fe3+ → Cu2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: ?(mol) ← 0,2(mol)
=> nCu= 0,2.12=0,1(���)20,2.1=0,1(mol)
⇒ m = mCu dư = 0,1 × 64 = 6,4 g
tick giúp tớ, cảm ơn bạn
Theo đề gọi \(n_{Zn}=x\left(mol\right),n_{Cu}=2x\left(mol\right)\)
Có:
\(m_{Zn}+m_{Cu}=19,3\\ \Leftrightarrow65x+64.2x=19,3\\ \Rightarrow x=0,1\)
=> Dung dịch sau \(\left\{{}\begin{matrix}SO_4^{2-}=0,6\\Fe^{2+}=0,4\\Zn^{2+}=0,1\\Cu^{2+}=0,1\end{matrix}\right.\)
\(\Rightarrow m_{kim.loại}=m_{Cu}=0,1.64=6,4\left(g\right)\)

\(3Zn+Fe_2\left(SO_4\right)_3\rightarrow3ZnSO_4+2Fe\)
x -------------0,2---------------------------\(\dfrac{2x}{3}\) (mol)
\(3Cu+Fe_2\left(SO_4\right)_3\rightarrow3CuSO_4+2Fe\)
2x -----------0,2------------------------------\(\dfrac{4x}{3}\) (mol)
Gọi x(mol) là số mol của Zn và Fe
Theo đề bài ta có:
\(m_{Zn}+m_{Cu}=m_{hh}\)
⇔ 65 . x + 64 . 2x = 19,3
⇔ x = 0,1(mol)
⇒ \(\left\{{}\begin{matrix}n_{Zn}=0,1\left(mol\right)\\n_{Cu}=0,2\left(mol\right)\end{matrix}\right.\)
\(n_{Fe}=\dfrac{2x}{3}+\dfrac{4x}{3}=\dfrac{2.0,1}{3}+\dfrac{4.0,2}{3}=0,33\left(mol\right)\)
\(m_{Fe}=n.M=0,33.56=18,48\left(g\right)\)
\(m_{Fe_2\left(SO_4\right)_3}=n.M=0,2.400=80\left(g\right)\)
Ta có: \(m_{hh}+m_{Fe_3\left(SO_4\right)_3}=m_{kl}+m_{Fe}\)
⇔ \(m_{kl}\) = 19,3 + 80 - 18,48 = 80,82(g)

Chọn đáp án C.
Hỗn hợp sau nung chứa 2 oxit là MgO và Fe2O3
chứng tỏ Mg và Zn phản ứng hết, Fe2(SO4)3 và CuSO4 phản ứng hết, FeSO4 còn dư.
Đặt y là số mol FeSO4 đã phản ứng
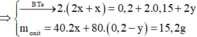

⇒ m C u + m F e = 17 , 44 g

Đáp án C
Hỗn hợp sau nung chứa 2 oxit là MgO và Fe2O3, chứng tỏ Mg và Zn phản ứng hết, Fe2(SO4)3 và CuSO4 phản ứng hết, FeSO4 còn dư.
Đặt y là số mol FeSO4 đã phản ứng
=> 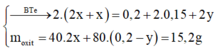
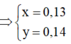 (1)
(1)
![]() = 17,44 (g)
= 17,44 (g)
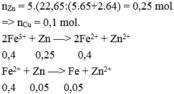

Đặt nZn = x (mol) và nCu = 2x (mol)
(Vì hỗn hợp bột gồm Zn và Cu có tỉ lệ về số mol là 1:2)
⇒ mhỗn hợp = mZn + mCu
= 65x + 64 × 2x) = 19,3 g
⇒ x = 0,1 mol
Có nFe3+ = 0,4 mol. Xảy ra các quá trình sau:
PTHH: Zn + 2Fe3+ → Zn2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: 0,1 → ?(mol)
=>nFe3+ = \(\dfrac{0,1.2}{1}\) = 0,2(mol)
PTHH: Cu + 2Fe3+ → Cu2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: ?(mol) ← 0,2(mol)
=> nCu= \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
⇒ m = mCu dư = 0,1 × 64 = 6,4 g