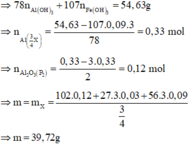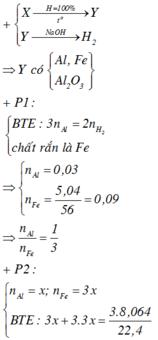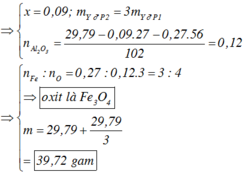Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm Fe2 O3 và Al trong điều kiện không có không khí thu được hỗn hợp chất rắn Y cho Y tác dụng với dung dịch NaOH dư thu được 0, 3 mol h2 Mặt khác nếu cho Y tác dụng với dung dịch HCl dư sẽ thu được 0, 4 mol H2O số mol Al trong x là bao nhiêu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Vì Y tác dụng với NaOH sinh ra khí H 2 nên có Al còn dư → Fe2O3 phản ứng hết.
Vậy Y gồm có Al dư, Al2O3 và Fe.
- Y tác dụng với NaOH sinh khí H 2 .
2Al + 2NaOH + 2H2O
→ 2NaAlO2 + 3 H 2 (1)
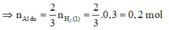
- Y tác dụng với HCl sinh khí H 2 .
2Al + 6HCl → 2 A l C l 3 +3 H 2 (2)
Fe + 2HCl → F e C l 2 + H 2 (3)
⇒ n H 2 (2) = 3/2 n A l d u = 3/2 . 0,2 = 0,3 mol
⇒ n H 2 (3) = n F e = n H 2 - n H 2 (2)
= 0,4-0,3= 0,1 mol
- Phản ứng nhiệt nhôm:
2Al + F e 2 O 3 → A l 2 O 3 + 2Fe (4)
Theo phản ứng (4) ta có:
⇒ n A l b đ = n A l d u + n A l p ư
= 0,2+0,1 = 0,3 mol⇒ Chọn A.

Đáp án A
n Al dư = 2nH2 / 3 = 0,1 mol
⇒ H = (0,25 – 0,1)/0,25 .100%= 60%
2Al + Fe2O3 → Al2O3 +2Fe
0,15
⇒ mZ = 160.(0,15 – 0,075) + 56.0,15 = 20,4 g

Đáp án B
P1 : + NaOH có khí H2 => Al dư , FexOy hết
=> mFe = 5,04g => nFe = 0,09 mol ; nAl dư = 0,03 mol = 2/3nH2
=> nFe + nAl = 0,12 mol
P2 : Fe và Al phản ứng tạo NO => nFe + nAl = nNO (bảo toàn e) = 0,36 mol = 3nP1
=> mP1 = 1/3mP2 = 9,93g => m = 9,93 + 29,79 = 39,72g
Xét P1 : mAl2O3 + mFe + mAl = mP1 = 9,93g => nAl2O3 = 0,04 mol => nO = 0,12 mol
=> nFe : nO = 0,09 : 0,12 = 3 : 4 => Fe3O4
=>B

Đáp án B
· Phần 1: + NaOH ® 0,045 mol H2
Þ Chứng tỏ oxit sắt phản ứng hết, Al dư:
![]()
Chất rắn còn lại là Fe:
![]()
· Phần 1: Có
Þ Chứng tỏ phần 2 nhiều gấp 3 lần phần 1.
· Khối lượng kết tủa lớn nhất khi toàn bộ lượng Al3+ và Fe3+ tạo kết tủa
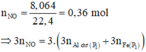
Þ Chứng tỏ phần 2 nhiều gấp 3 lần phần 1.
· Khối lượng kết tủa lớn nhất khi toàn bộ lượng Al3+ và Fe3+ tạo kết tủa.