Bài 1: Để hòa tan hết 31.05g hỗn hợp oxit gồm FeO và ZnO thì cần vừa đủ Vml dung dịch H2SO4 2M. Cô cạn dung dịch sau phản ứng thu được 63.05g muối khan. Xác định thể tích dung dịch H2SO4 đem dùng.
Bài 2: Cho 40g hỗn hợp Cu và ZnO tác dụng với dung dịch HCl loãng dư, lọc lấy phần không tan cho tác dụng với H2SO4 đặc nóng thì thu được 5.6l khí (đktc). Tính thành phần phần trăm theo khối lượng các chất trong hỗn hợp ban đầu.

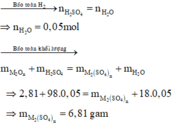
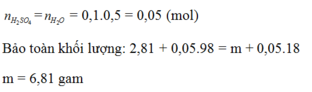


1.
Đặt nFeO = x (mol); nZnO = y (mol); ( x, y > 0 )
FeO + H2SO4 \(\rightarrow\) FeSO4 + H2O (1)
ZnO + H2SO4 \(\rightarrow\) ZnSO4 + H2O (2)
Từ (1)(2) ta có hệ pt
\(\left\{{}\begin{matrix}72x+81y=31,05\\152x+161y=63,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,15\\y=0,25\end{matrix}\right.\)
\(\Rightarrow\) VH2SO4 = \(\dfrac{0,15+0,25}{2}\) = 0,2 (l)
nSO2 = 0,25 mol
ZnO +2HCl \(\rightarrow\) ZnCl2 + H2O (1)
Cu + 2H2SO4 đặc \(\underrightarrow{t^o}\) CuSO4 + SO2 + H2O (2)
Từ (2)
\(\Rightarrow\) %Cu = \(\dfrac{0,25.64.100}{40}\) = 40%
\(\Rightarrow\)%ZnO = 100% - 40% = 60%