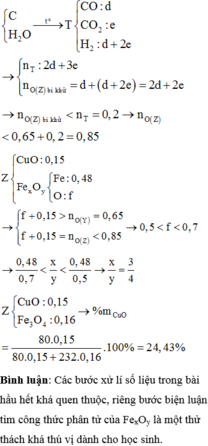Thổi khí CO dư qua m gam hỗn hợp X gồm CuO và MxOy, sau phản ứng xảy ra hoàn toàn thu được 12g hỗn hợp kim loại và 10,08l khí CO2. Mặt khác, hòa tan hoàn toàn m gam hỗn hợp X vào 200g dung dịch HCl x% thì sau phản ứng thu được dung dịch Y chứa 29,75g chất tan
a) Tính thành phần phần trăm về khối lượng của mỗi oxit trong X.
b) Biết HCl dùng dư 20% so với lượng phản ứng. Tính giá trị của x?
c) Tính nồng độ phần trăm của mỗi chất tan trong Y?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

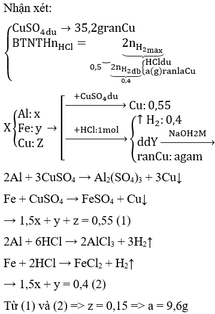
Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.


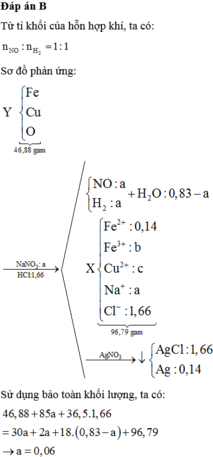
Đáp án B
Trong 22 gam hỗn hợp X ta đặt nCuO= x mol; n F e 2 O 3 = y mol
→ 80x + 160y= 22 gam (1)
- Hòa tan hoàn toàn 44 gam X bằng dung dịch HCl dư thu 85,25 gam muối.
→ Hòa tan hoàn toàn 22 gam X thu được 85,25/ 2= 42,625 gam
C u O + 2 H C l → C u C l 2 + H 2 O x x m o l F e 2 O 3 + 6 H C l → 2 F e C l 3 + 3 H 2 O y 2 y m o l
Ta có: mmuối= m C u C l 2 + m F e C l 3
=135x+ 162,5.2y= 42,625 gam (2)
Giải hệ gồm PT (1) và (2) ta có x=0,075 mol; y= 0,1 mol
CuO + CO → t 0 Cu + CO2
Fe2O3+ 3CO → t 0 2Fe + 3CO2
Ta có: nC O 2 = nCuO+ 3.n F e 2 O 3 = x + 3y= 0,375 mol
CO2+ Ba(OH)2 → BaCO3+ H2O
→nBaCO3= nCO2= 0,375 mol
→mBaCO3= 0,375.197=73,875 gam

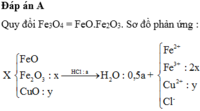
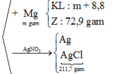
Bảo toàn khối lượng, ta có :
mmuối(Y) = mmuối(Z) + mKL - mMg = 72,9 + m + 8,8 - m = 81,7 gam
mX + mHCl = m H 2 O + mmuối(Y)
→ 43,2 + 36,5a = 18.0,5a + 81,7 → a = 1,4 = nAgCl
![]()
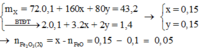
Sai lầm thường gặp : Cho rằng
n
F
e
2
O
3
(
X
)
= x = 0,15 và chọn C.

1) \(\left\{{}\begin{matrix}n_{CO}+n_{CO_2}=\dfrac{3,136}{22,4}=0,14\left(mol\right)\\\dfrac{28.n_{CO}+44.n_{CO_2}}{n_{CO}+n_{CO_2}}=16.2=32\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{CO}=0,105\left(mol\right)\\n_{CO_2}=0,035\left(mol\right)\end{matrix}\right.\)
nO = nCO2 = 0,035 (mol)
=> a = 2,92 + 0,035.16 = 3,48(g)
\(n_{H_2SO_4}=\dfrac{100.5,39\%}{98}=0,055\left(mol\right)\)
nH2O = nO = 0,035 (mol)
Bảo toàn H: \(n_{H_2}=\dfrac{0,055.2-0,035.2}{2}=0,02\left(mol\right)\)
=> \(V=0,02.22,4=0,448\left(l\right)\)
2) Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Fe_3O_4}=b\left(mol\right)\\n_{CuO}=c\left(mol\right)\end{matrix}\right.\)
=> 56a + 232b + 80c = 3,48 (1)
Bảo toàn Fe: nFe = a + 3b (mol)
Bảo toàn Cu: nCu = c (mol)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,02<-0,02<------0,02<---0,02
Fe3O4 + 4H2SO4 --> Fe2(SO4)3 + FeSO4 + 4H2O
b--->4b------------>b-------------->b
CuO + H2SO4 --> CuSO4 + H2O
c---->c------------>c
=> a = 0,02
=> 0,02 + 4b + c = 0,055 => 4b + c = 0,035
(1) => 232b + 80c = 2,36
=> b = 0,005 (mol); c = 0,015 (mol)
B chứa \(\left\{{}\begin{matrix}FeSO_4:0,025\left(mol\right)\\Fe_2\left(SO_4\right)_3:0,005\left(mol\right)\\CuSO_4:0,015\left(mol\right)\end{matrix}\right.\)
mdd sau pư = 3,48 + 100 - 0,02.2 = 103,44 (g)
=> \(\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{0,025.152}{103,44}.100\%=3,674\%\\C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,005.400}{103,44}.100\%=1,933\%\\C\%_{CuSO_4}=\dfrac{0,015.160}{103,44}.100\%=2,32\%\end{matrix}\right.\)
3)
Rắn khan chứa \(\left\{{}\begin{matrix}BaSO_4\\Fe\left(OH\right)_3\\Cu\left(OH\right)_2\end{matrix}\right.\)
Có: \(n_{BaSO_4}=n_{SO_4}=0,055\left(mol\right)\)
Bảo toàn Fe: \(n_{Fe\left(OH\right)_3}=n_{FeSO_4}+2.n_{Fe_2\left(SO_4\right)_3}=0,035\left(mol\right)\)
Bảo toàn Cu: \(n_{Cu\left(OH\right)_2}=0,015\left(mol\right)\)
=> b = 0,055.233 + 0,035.107 + 0,015.98 = 18,03 (g)