Cho 11,3 gam hỗn hợp Mg, Al và Zn tác dụng với dung dịch H2SO4 2M dư thì thu được 6,72 lit khí (đktc). Cô cạn dung dịch thu được sau phản ứng thu được khối lượng muối khan là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Số mol H2 thu được là : n H 2 = 11 , 2 22 , 4 = 0 , 5 mol
Gọi M là kim loại chung cho Al và Mg với hóa trị n
Sơ dồ phản ứng :
M ⏟ 10 , 2 gam + H 2 S O 4 ( l o ã n g , d ư ) → M 2 ( S O 4 ) n ⏟ m u ố i + H 2 ↑ ⏟ 0 , 5 m o l
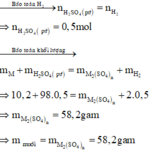

Đáp án A
Gọi M là kim loại chung cho Zn và Mg với hóa trị n
Sơ đồ phản ứng: M + H 2 SO 4 ( loãng , dư ) → M 2 ( SO 4 ) n ⏟ muối + H 2 ↑
Khí thu được là
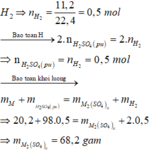

Đáp án D
Giải hệ số mol khí ta có 0,04mol N2O và 0,26 mol NO
Hỗn hợp X tác dụng với HNO3 và H2SO4 đều dùng dư nên lượng electron cho ở hai trường hợp trên như nhau.
Lượng electron nhận ở hai thí nghiệm: 8.0,04 + 3.0,26 = 1,1mol < 0,7.2 = 1,4mol
Có NH4NO3 nên chênh lệch trên → có (1,4 – 1,1) : 8 = 0,0375 mol NH4NO3
⇒ ∑ mmuối nitrat kim loại = 129,4 – 0,0375.80
= 126,4 gam dạng M(NO3)n
Lại có 104 gam muối sunfat kim loại dạng M2(SO4)n || Tương quan 1SO4 ⇄ 2NO3
→ Tăng giảm khối lượng có số mol gốc sunfat = (126,4 – 104) : (62.2 – 96) = 0,8mol
→ Bảo toàn nguyên tố S có: 0,8 + 0,7 = 1,5mol H2SO4, tiếp tục bảo toàn H có 1,5mol H2O
→ BTKL phản ứng X + H2SO4 ta có m = 104 + 0,7.64 + 1,5.18 – 1,5.98 = 28,8gam

Chọn A.
→ B T : e c h o 1 v à 2 n N H 4 N O 3 = 2 n S O 2 - 3 n N O - 8 n N 2 O 8 = 0 , 0375 m o l
Gọi T là hỗn hợp muối chứa Fe(NO3)2 và Mg(NO3)2 suy ra: m T = m Y - m N H 4 N O 3 = 126 , 4 g a m
Áp dụng phương pháp tăng giảm khối lượng + bảo toàn điện tích cho hỗn hợp T và Z ta có:



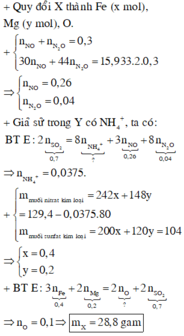
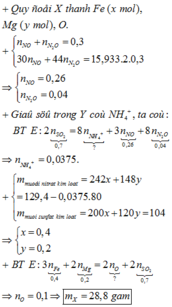

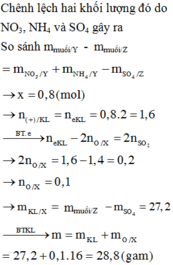


Bảo toàn nguyên tố ta có
\(n_{H_2}=n_{H_2SO_4}=\dfrac{6,72}{22,4}=0.3\) (mol)
Sau khi cô cạn dd ta được : ion kim loại : 11,3g và SO42- 0.3 mol
⇒ m = 30.5 g
Hình như sai rồi đó ạ