Người ta điều chế 22,4 gam đồng bằng cách dùng khí hidro để khử đồng (2) oxit.
a) Tính khối lượng đồng (2) oxit bị khử
b) Tính thể tích khí hidro (đktc) phải dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: CuO + H2 → Cu + H2O
Số mol của Cu là: 24 : 64 = 0,375 (mol)
Số mol của H2 là: 0,375 mol
Thể tích hiđrô đã dùng là: 0,375 . 22,4 = 8,4 lít
Số mol của CuO là: 0,375 mol
Khối lượng CuO bị khử là: 0,375 . 80 = 30 gam

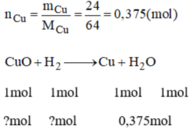
Theo pt: n H 2 = n C u O = 0,375 mol
V H 2 = n H 2 .22,4 = 0,375.22,4 = 8,4(l)
→ Chọn A.

PTHH: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
a+b) \(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Fe_2O_3}=0,2\left(mol\right)\\n_{H_2}=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe_2O_3}=0,2\cdot160=32\left(g\right)\\V_{H_2}=0,6\cdot22,4=13,44\left(l\right)\end{matrix}\right.\)
c) PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
Theo PTHH: \(n_{Zn}=n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,6\cdot65=39\left(g\right)\)
a,
nFe = 22,4/56 = 0,4 (mol)
PTHH
Fe2O3 + 3H2 ---to----) 2Fe + 3H2O (1)
theo phương trình (1) ,ta có:
nFe2O3 = 0,4 x 2 / 1 = 0,8 (mol)
mFe2O3 = 160 x 0,8 = 128 (g)
b,
theo pt (1)
nH2 = (0,4 x 3)/2 = 0,6 (mol)
=) VH2 = 0,6 x 22,4 = 13,44 (L)
c,
PTHH
Zn + H2SO4 -------------) ZnSO4 + H2 (2)
Số mol H2 cần dùng là 0,6 (mol)
Theo PT (2) :
nZn = nH2 ==) nZn = 0,6 x 65 = 39 (g)

nCu = 8: 80=0,1(mol)
a) PTHH : CuO + H2 -t--> Cu +H2O
0,1-> 0,1------>0,1(mol)
mCu = 0,1.64=6,4(g)
VH2 = 0,1.22,4=2,24(l)

a) nCu=0,2(mol)
PTHH: CuO + H2 -to-> Cu + H2O
b) nH2=nCuO=nCu=0,2(mol)
=>V(H2,đktc)=0,2.22,4=4,48(l)
c) mCuO=0,2.80=16(g)

\(pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
8,2 8,2 8,2
\(m_{Cu}=8,2.64=524,8g\\
V_{H_2}=8,2.22,4=183,68l\)
pthh:CuO+H2to→Cu+H2Opthh:CuO+H2to→Cu+H2O
8,2 8,2 8,2
mCu=8,2.64=524,8gVH2=8,2.22,4=183,68l

\(n_{CuO}=\dfrac{36}{80}=0,45\left(mol\right)\\ PTHH:CuO+H_2\underrightarrow{t^o}Cu+H_2O\\ Theo.pt:n_{H_2}=n_{Cu}=n_{H_2O}=n_{Cu}=0,45\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Cu}=0,45.64=28,8\left(g\right)\\m_{H_2O}=0,45.18=8,1\left(g\right)\\V_{H_2}=0,45.22,4=10,08\left(l\right)\end{matrix}\right.\)
nCu = 0,35 mol
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
⇒ mCuO = 0,35.80 = 28 (g)
⇒ VH2 = 0,35.22,4 = 7,84 (l)