1 (2đ) Khử 5,43 g một hỗn hợp gồm có CuO và PbO bằng khí H2, thu được 0,9g H2O
a) Viết phương trình hoá học xảy ra?
b) Tính thành phần phần tram theo khối lượng của các oxit có trong hỗn hợp ban đầu?
c) Tính thành phần phần tram theo khối lượng của hỗn hợp rắn thu được sau phản ứng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2O=0,9/18=0,05(mol)
pt: CuO+H2--t*-->Cu+H2O
x______________x____x
PbO+H2--->Pb+H2O
y_________y_____y
Hệ pt:
\(\left\{{}\begin{matrix}80x+223y=5,43\\x+y=0,05\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,04\\y=0,01\end{matrix}\right.\)
=>mCuO=0,04.80=3,2(g)
=>%mCuO=3,2/5,43.100%~59%
=>%mPbO=100%-59%=41%
mCu=0,04.64=2,56(g)
mPb=0,01.207=2,07(g)
=>mhh rắn=2,56+2,07=4,63(g)
=>%mCu=2,56/4,63.100%~55,3%
=>%mPb=100%-55,3%=44,7%
nH2O = 0,05 mol
Gọi x,y lần lượt là số mol của Cuo và PbO ( x,y > 0 )
CuO + H2 ---to---> Cu + H2O
x...........x................x.........x
PbO + H2 ---to---> Pb + H2O
y............y................y.......y
Ta có hệ
\(\left\{{}\begin{matrix}80x+223y=5,43\\x+y=0,05\end{matrix}\right.\)
⇒ \(\left\{{}\begin{matrix}x=0,04\\y=0,01\end{matrix}\right.\)
⇒ %CuO = \(\dfrac{0,04.80.100\%}{5,43}\) \(\approx\)58,9%
⇒ %PbO = \(\dfrac{0,01.223.100\%}{5,43}\) \(\approx\) 41,1%
⇒ mchất rắn thu được = ( 0,04.64 ) + ( 0,01.207 ) = 4,63 (g)
⇒ %Cu = \(\dfrac{0,04.64.100\%}{4,63}\)\(\approx\) 55,3%
⇒ %Pb = \(\dfrac{0,01.207.100\%}{4,63}\) \(\approx\) 44,7%

CuO +H2 --> Cu +H2O(1)
PbO +H2 --> Pb +H2O(2)
a) giả sử nCuO=x(mol)
nPbO=y(mol)
=> 80x+ 223y=5,43 (I)
theo (1) : nH2O=nCuO=x(mol)
theo (2) : nH2O=nPbO=y(mol)
=> 18x+18y=0,9(II)
từ (I) và (II) ta có :
80x + 223y=5,43
18x+18y=0,9
=>x=0,04(mol) , y=0,01(mol)
=>mCuO=0,04 .80=3,2(g)
mPbO=0,01 .223=2,23(g)
=> %mCuO=3,2/5,43 .100=58,93(%)
%mPbO=100 -58,93=41,07(%)
b) theo (1)(2) : nH2=nH2O=0,9/18=0,05(mol)
=> mH2=0,1(g)
ADĐLBTKL ta có :
mhh sau phản ứng=5,43+0,1 -0,9=4,63(g)
theo (1) :nCu=nCuO=0,04(mol)
=> %mCu=0,04 .64/4,63 .100=55,29(%)
%mPbO=100 -55,29=44,71(%)

khối lượng bình tăng lên là khối lượng H2O
nH2O=0,9/18=0,05 mol
goi x,y ll là số mol CuO và PbO
kê mol vào phương trình
ta có:80x+223y=5,43 (1); x+y=0,05 (2)
giải hpt 1 và 2 :x=0,04 mol; y=0,01 mol
%CuO=0,04.80.100/5,43=59%; %PbO=100-59=41%
PTHH: CuO + H2→ Cu + H2O (1)
PbO + H2→ Pb + H2O (2)
Sau phản ứng chất khí dẫn qua bình đựng P2O2 thấy khối lượng bình giảm 0,9 gam =>mH20 = 0,9 gam => nH20 = 0,9 /18 = 0,05 mol
Gọi số mol CuO và PbO lần lượt là x mol và y mol (x,y > 0)
Ta có PTĐS: 80x + 223y = 5,43 =>
Theo PTHH (1) ta có: nH20 = nCuO= x mol
Theo PTHH (2) ta có: nH2O = nPbO = y mol
x + y = 0,05 => y = 0,05 – x (b)
Thay (b) vào (a) giai ra ta có x = 0,04; y = 0,01 mol
Vậy % theo khối lượng của CuO và PbO là 59%; 40,06%
tớ giải rùi đó .Nhớ tick nhé![]()
![]()

a.PTHH: CuO + H2→ Cu + H2O (1)
PbO + H2→ Pb + H2O (2)
Sau phản ứng chất khí dẫn qua bình đựng P2O2 thấy khối lượng bình giảm 0,9 gam =>mH20 = 0,9 gam => nH20 = 0,9 /18 = 0,05 mol
Gọi số mol CuO và PbO lần lượt là x mol và y mol (x,y > 0)
Ta có PTĐS: 80x + 223y = 5,43 =>
b.Theo PTHH (1) ta có: nH20 = nCuO= x mol
Theo PTHH (2) ta có: nH2O = nPbO = y mol
x + y = 0,05 => y = 0,05 – x (b)
Thay (b) vào (a) giai ra ta có x = 0,04; y = 0,01 mol
Vậy % theo khối lượng của CuO và PbO là 59%; 40,06%

nH2O=0,9/18=0,05(mol)
pt: CuO+H2--->Cu+H2O
x_____________x____x
PbO+H2--->Pb+H2O
y__________y___y
Ta có hệ:
\(\left\{{}\begin{matrix}80x+223y=5,43\\x+y=0,05\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,04\\y=0,01\end{matrix}\right.\)
=>mCuO=0,04.80=3,2(g)
=>%mCuO=3,2/5,43.100%=58,9%
=>%mPbO=100%-58,9%=41,1%
c) mCu=0,04.64=2,56(g)
mPb=0,04.207=8,28(g)
=>m chất rắn=2,56+8,28=10,84(g)
=>%mCu=2,56/10,84.100%=23,6%
=>mPb=100%-23,6%=76,4%
nH2O=0,9/18=0,05mol
Gọi nH2O PỨ(1)là x(mol,x>0)
=>nH2O PỨ(2) là 0,05-x(mol
CuO+H2->Cu+H2O(1)
x____________ x(mol
PbO+H2->Pb+H2O(2)
0,05-x_______0,05-x(mol)
mh2=mCuO+mPbO=80x+223(0,05-x)=5,43
=>80x+11,15-223x=5,43=>143x=5,72=>x=0,04mol
->mCuO=80.0,04=3,2g
->%mCuO=3,2/5,43.100%=58,93%
->%PbO=100%-58,93%=41,07%

a)PTHH:CuO+H2\(\underrightarrow{t^0}\)H2O+Cu(1)
PbO+H2\(\underrightarrow{t^0}\)H2O+Pb(2)
3H2O+P2O5\(\underrightarrow{ }\)2H3PO4
b) Do bình tăng lên 0,9 gam. Do đó:\(m_{H_2O}=0,9\left(gam\right)\)
Gọi khối lượng của CuO là x(o<x<5,43)
khối lương của PbO là 5,43-x
Theo PTHH(1):80 gam CuO tạo ra 18 gam H2O
Vậy:x gam CuO tạo ra \(\frac{9x}{40}\) gam H2O(3)
Theo PTHH(2):223 gam PbO tạo ra 18 gam H2O
Vậy:5,43-x gam PbO tạo ra \(\frac{18\left(5,43-x\right)}{223}\) gam H2O(4)
Từ (3) vfa (4) ta có PT:\(\frac{9x}{40}\)+\(\frac{18\left(5,43-x\right)}{223}\)=0,9
\(\Rightarrow x=3,2\left(gam\right)\)
\(\Rightarrow m_{CuO}=3,2\left(gam\right);m_{PbO}=5,43-3,2=2,23\left(gam\right)\)
Do đó:\(\%m_{CuO}=\frac{3,2}{5,43}.100\%=58,93\left(\%\right)\)
\(\%m_{PbO}=100\%-58,93=41,07\left(\%\right)\)
CuO+H2\(\rightarrow\)Cu+H2O(1)
PbO+H2 \(\rightarrow\)Pb+H2O(2)
P2O5+3H2O\(\rightarrow\) 2H3PO4(3)
Theo PT(3) có: vì đây là phản ứng hóa hợp nên khối lượng mà bình tăng thêm=mH2O=0,9g
nH2O(pt1+pt2)=\(\dfrac{0,9}{18}\)=0,05mol
Gọi nH2(pt1)=a
nH2(pt2)=b
=> a+b=0,05 <=> b=0,05-a
Theo PT1: nCuO=nH2(PT1)=a
Theo PT2:nPbO=nH2(pt2)=b
Có mCuO+mPbO=5,43g
=>80a+223b=5,43
=>80a+223(0,05-a)=5,43
=>80a+11,15-223a=5,43
=>143a=5,72
=>a=0,04 mol
=> mCuO=0,04.80=3,2g
=>C%CuO=\(\dfrac{3,2}{5,43}\).100%=59%
C%PbO=100%-59%=41%

_Nung nóng hỗn hợp gồm CuO và PbO bằng C:
Gọi a,b là số mol của CuO và PbO:
=>80a+223b=19.15(1)
2CuO+C(t*)=>2Cu+CO2
a------->0.5a--->a--->0.5a(mol)
2PbO+C(t*)=>2Pb+CO2
b------>0.5b---->b---->0.5b(mol)
_Cho CO2 sản phẩm vào dd Ca(OH)2 thu được kết tủa trắng CaCO3:
+nCaCO3=7.5/100=0.075(mol)
CO2+Ca(OH)2=>CaCO3+H2O
0.075---------------->0.075(mol)
=>0.5a+0.5b=0.075(2)
Từ(1)(2)=>a=0.1,b=0.05
=>mCuO=0.1*80=8(g)
=>mPbO=0.05*223=11.15(g)
+nCu=0.1(mol)
=>mCu=0.1*64=6.4(g)
+nPb=0.05(mol)
=>mPb=0.05*207=10.35(g)
=>m(KL)=6.4+10.35=16.75(g)
c)
+nC=0.5(a+b)=0.5(0.1+0.05)=0.075(mol)
=>mC=0.075*12=0.9(g)

1. Phương trình hoá học của các phản ứng:
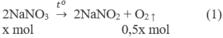
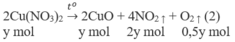
2. Đặt X và y là số mol của N a N O 3 và C u ( N O 3 ) 2 trong hỗn hợp X. Theo các phản ứng (1) và (2) số mol NO2 thu được là 2y mol và tổng số mol oxi là (0,5x + 0,5y) mol.
Biết khối lượng mol của hai chất N a N O 3 và Cu(NO3)2 tương ứng là 85 và 188 (g/mol), ta có hệ phương trình :
85x + 188y = 27,3 (a)
0,5x + 2y + 0,5y = 0,3 (b)
Giải hệ phương trình (a), (b) được : x = y = 0,1.
Phần trăm khối lượng của mỗi muối trong hỗn hợp X :
![]()
% m C u ( N O 3 ) 2 = 100% - 31,1% = 68,9%

Đặt : \(n_{CuO}=a\left(mol\right),n_{ZnO}=b\left(mol\right)\)
\(\Rightarrow80a+81b=28,25g\left(1\right)\)
a) Pt : \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
b) Ta có : \(n_{HCl}=\dfrac{20\%.127,75}{100\%.36,5}=0,7\left(mol\right)\Rightarrow2a+2b=0.7\left(2\right)\)
Từ (1),(2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1=n_{CuCl2}\\b=0,25=n_{ZnCl2}\end{matrix}\right.\)
c) \(m_{muối}=m_{CuCl2}+m_{ZnCl2}=0,1.135+0,25.136=47,5\left(g\right)\)
d) \(\left\{{}\begin{matrix}C\%_{CuCl2}=\dfrac{0,1.135}{28,25+127,75}.100\%=8,65\%\\C\%_{ZnCl2}=\dfrac{0,25.136}{28,25+127,75}.100\%=21,79\%\end{matrix}\right.\)


nH2O = 0,05 mol
Gọi x, y lần lượt là số mol của CuO, PbO ( x, y > 0 )
CuO + H2 ---to---> Cu + H2O
x.........x.....................x.......x
PbO + H2 ----to---> Pb + H2O
y..........y....................y.......y
Ta có hệ
\(\left\{{}\begin{matrix}80x+223y=5,34\\x+y=0,05\end{matrix}\right.\)
⇒ \(\left\{{}\begin{matrix}x=0,04\\y=0,01\end{matrix}\right.\)
⇒ %CuO = \(\dfrac{0,04.80.100\%}{5,43}\)\(\approx\) 58,9%
⇒ %PbO = \(\dfrac{0,01.223.100\%}{5,43}\) \(\approx\) 41,1%
mhỗn hợp chất rắn thu được = ( 0,04.64 ) + ( 0,01.207 ) = 4,63 (g)
⇒ %Cu = \(\dfrac{0,04.64.100\%}{4,63}\) \(\approx\) 55,3%
⇒ %Pb = \(\dfrac{0,01.207.100\%}{4,63}\) \(\approx\) 44,7%
a) CuO + H2 =(t*)=> Cu + H2O
PbO + H2 =(t*)=> Pb + H2O
b) gọi số mol CuO và PbO lần lượt là x,y
CuO + H2 =(t*)=> Cu + H2O
x____________________x
PbO + H2 =(t*)=> Pb + H2O
y____________________y
m hh = 80x + 223y = 5,43 (1)
x + y = n H2O = 0,9 / 18 = 0,05 (2)
Từ (1) (2) => x = 0,04 và y = 0,01
=> m CuO = 0,04 x 80 = 3,2 (g) => %m CuO = 3,2 / 5,43 x 100% = 58,93%
=> %m PbO = 100% - 58,93% = 41,01%
c)
n Cu = n CuO = 0,04 => m Cu = 0,04 x 64 = 2,56 (g)
n Pb = n PbO = 0,01 => m Pb = 0,01 x 223 = 2,23 (g)
=> %m Cu = 2,56 / 4,79 x 100% = 53,44% => %m Pb = 46,56%