Bài 1: Nung nóng hh X gồm 10,4g Zn và 3,2g S trong bình kín không có không khí. Sau phản ứng thu được chất rắn A. Cho toàn bộ A và dd HCl dư thu được bao nhiêu lít khí (đktc)?
Bài 2: Cho hh FeS, Fe phản ứng hoàn toàn với H2SO4 0,5M thu được 2,464 lít hh khí X ở đktc. Cho hh khí X thu được vào dd Pb(NO3)2 được 23,9g kết tủa màu đen. Tính m% của mỗi chất rắn trong hh ban đầu?
Bài 3: Cho 55g hh 2 muối Na2SO3 và Na2CO3 tác dụng hết với H2SO4 loãng thu được hỗn hợp khí A có tỷ khối hơi đối với hidro là 24. Tính m% mỗi muối trong hh đầu.
Bài 4: Cho 11g hh Al, Fe phản ứng hoàn toàn với H2SO4 đặc nóng thu được 10,08 lít SO2 sản phẩm khử duy nhất ở đktc và dd A.
a) Tính m% của mỗi kim loại trong hh?
b) Cho NaOH dư vào dd A thu được m gam một kết tủa, nung kết tủa này ngoài không khí tới khối lương không đổi thu được a gam một chất rắn, tính m và a?

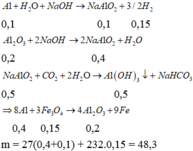
Bài 4:
Al (0) -> Al (+3) + 3e
x ----------------------- 3x
Fe (0) -> Fe (+3) + 3e
y ---------- 0,1 mol -- 3y
S (+6) + 2e -> S (+4)
--------- 0,9 mol - 0,45 mol
nSO2 = 10,08 / 22,4 = 0,45 mol
Ta có: Tổng e cho = Tổng e nhận => 3x + 3y = 0,9 (1)
Hỗn hợp là 11g, vậy ta có: mAl + mFe = 11 => 27x + 56y = 11 (2)
Từ (1) (2) => x = 0,2 mol, y = 0,1 mol
% mAl = (0,2 x 27 x 100) / 11 = 49,09%
% mFe = 100% - 49,09% = 50,91%
Dung dịch A: Al2(SO4)3 và Fe2(SO4)3
Vì khi cho từ từ dung dịch NaOH và dung dịch Al2(SO)3. NaOH sẽ tác dụng với Al2(SO4)3 theo phương trình sau:
NAOH + Al2(SO4)3 ---> Na2SO4 + Al(OH)3 (kết tủa)
Al(OH)3 sinh ra sẽ tác dụng với dung dịch NaOH (đề bài cho NaOH dư), kết tủa tan dần:
Al(OH)3 + NaOH --> NaAlO2 + 2H2O
=> kết tủa thu được là do Fe2(SO4)3 tạo ra
Fe2(SO4)3 + 6NaOH --> 2Fe(OH)3 + 3Na2SO4
0,1 mol ------------------------ 0,2 mol
mFe(OH)3 = 0,2 x (56 + 16 x 3 + 3) = 21,4g
2Fe(OH)3 --t---> Fe2O3 + 3H2O
0,2 mol ---------- 0,1 mol
mFe2O3 = 0,1 x (56 x 2 + 16 x 3) = 16g