Hòa tan hết 4,2 gam hỗn hợp Fe và kim loại A hóa trị II vào dung dịch HCl thu được 2,24 lít khí đktc Nếu 5,5 gam kim loại A tác dụng với dung dịch loãng có chứa 14,7 gam H2SO4 thì sau phản ứng axit vẫn còn dư Xác định kim loại A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Fe} = a(mol) ; n_M = b(mol)\\ \Rightarrow 56a + Mb = 12\)
\(Fe + 2HCl \to FeCl_2 + H_2\\ M + 2HCl \to MCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{4,48}{22,4} = 0,2(mol)\\ \Rightarrow a = 0,2 - b ( 0< b < 0,2)\)
Suy ra:
56(0,2 - b) + Mb = 12
\(\Rightarrow M = \dfrac{0,8 + 56b}{b}\)
Vì 0 < b < 0,12
Nên M > 62,67(1)
Mặt khác,
\(n_M > \dfrac{1}{2}n_{HCl} = 0,35\\ \Rightarrow M < \dfrac{23,8}{0,35} = 68(2)\)
Từ (1)(2) suy ra: 62,67 < M < 68
Do đó, M = 65(Zn) thì thỏa mãn
Vậy M là Zn(Kẽm)

Đáp án C
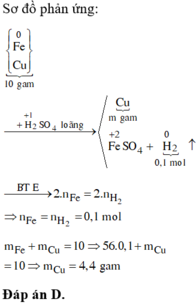
nFe = nH2 = 0,1 mol
Chất rắn không tan là Cu
=> m = 10 – mFe = 10 – 0,1 . 56 = 4,4g

Phương trình hóa học của phản ứng:
Cu + H 2 SO 4 → Không phản ứng
Fe + H 2 SO 4 → FeSO 4 + H 2
n H 2 = 2,24/22,4 = 0,1 mol
n Fe = 0,1 x 56 = 5,6g. Khối lượng Cu không hòa tan là
m = 10 - 5,6 = 4,4g

Đáp án C
nFe = nH2 = 0,1 => mFe = 5,6g => mCu = 10 – 5,6 = 4,4g => Chọn C.



Tương tự nè:
https://hoc24.vn/hoi-dap/question/64498.html