Khử hoàn toàn 16g bột một loại oxit sắt nguyên chất bằng CO ở nhiệt độ cao Sau khi kết thúc phản ứng khối lượng chất rắn giảm đi 4,8g
a) Hãy cho biết công thức hóa học của oxit sắt đã dùng
b) Chất khí sau phản ứng được dẫn vào bình đựng dung dịch NaOH dư Khối lượng của bình tăng hay giảm bao nhiêu gam
c) Hãy cho biết thể tích khí CO(đo ở đktc) cần dùng cho phản ứng trên là bao nhiêu? Biết rằng người ta đã dùng khí CO dư 10% so với lý thuyết

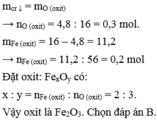

a.PTHH: FexOy + yCO →to→ xFe + yCO2
mFexOy = 16g
Sau phản ứng hoàn toàn, khối lượng chất rắn giảm 4,8g, suy ra mO = 4,8g.
=> mFe = mFexOy - mO = 11,2
=> nFe = 11,2/56=0,2mol và nO = 4,8/16=0,3
=> x/y=nFe/nO=0,2/0,3=2/3
Vậy công thức oxit là Fe2O3.
c. Lượng CO dư 10% so với lý thuyết.
nCOlý thuyết = nCO2 = 0,3
nCOthực thế = nCOlý thuyết *110/100 = 0,33 mol
=> VCO = 7,392 lít
mFe=16-4,8=11,2(g)
=>nFe=11,2/56=0,2(mol)
pt: FexOy+yCO--->xFe+yCO2
0,2/x____________0,2
Ta có:
nFexOy=16/(56x+16y)
=>x/y=2/3
=>CT: Fe2O3
nCO2=0,2.3/2=0,3(mol)
pt: CO2+2NaOH--->Na2CO3+H2O
Khối lượng của bình tăng=mCO2
=>mCO2=0,3.44=13,2(g)
VCO=0,3.22,4=6,72(l)
VCO cần dùng =6,72+6,72.10%=7,392(l)