Có 5 lọ không nhãn đựng riêng biệt từng dung dịch sau HCl; NaOH; Ca(OH)2; CuSO4; NaCl hãy phân biệt từng chất riêng biệt trong mỗi lọ bằng phương pháp hóa học và viết các phương trình hóa học xảy ra
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Lấy một phần mỗi dung dịch vào từng ống nghiệm, rồi nhỏ dung dịch HCl vào. Ở ống nghiệm có khí thoát ra là ống đựng dung dịch N a 2 C O 3 .
![]()
- Phân biệt dung dịch H 3 P O 4 , B a C l 2 , ( N H 4 ) 2 S O 4 bằng cách cho N a 2 C O 3 tác dụng với từng dung dịch: dung dịch nào khi phản ứng cho khí thoát ra là H3PO4, dung dịch nào khi phản ứng có kết tủa trắng xuất hiện là B a C l 2 , dung dịch nào khi phản ứng không có hiện tượng gì là ( N H 4 ) 2 S O 4 :
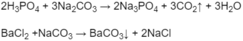

1. - Trích mẫu thử.
- Hòa tan từng mẫu thử vào nước.
+ Tan: K2CO3, KHCO3 và KCl. (1)
+ Không tan: CaCO3.
- Cho dd mẫu thử nhóm (1) pư với HCl dư.
+ Có khí thoát ra: K2CO3, KHCO3. (2)
PT: \(K_2CO_3+2HCl\rightarrow2KCl+CO_2+H_2O\)
\(KHCO_3+HCl\rightarrow KCl+CO_2+H_2O\)
+ Không hiện tượng: KCl.
- Cho mẫu thử nhóm (2) pư với BaCl2.
+ Xuất hiện kết tủa trắng: K2CO3.
PT: \(K_2CO_3+BaCl_2\rightarrow2KCl+BaCO_{3\downarrow}\)
+ Không hiện tượng: KHCO3.
- Dán nhãn.
2. - Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào dd BaCl2.
+ Xuất hiện kết tủa trắng: Na2CO3.
PT: \(Na_2CO_3+BaCl_2\rightarrow2NaCl+BaCO_{3\downarrow}\)
+ Không hiện tượng: NaOH, Ca(OH)2 và HCl. (1)
- Cho mẫu thử nhóm (1) pư với Na2CO3 vừa nhận biết được.
+ Có khí thoát ra: HCl.
PT: \(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
+ Không hiện tượng: NaOH, Ca(OH)2. (2)
- Sục CO2 vào mẫu thử nhóm (2).
+ Xuất hiện kết tủa trắng: Ca(OH)2.
PT: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
+ Không hiện tượng: NaOH.
PT: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
- Dán nhãn.
Gia Bảo Đinh
Xin lỗi bạn, mình nhìn nhầm đề, nhưng mà cách nhận biết vẫn như vậy. Bạn sửa từ KHCO3 thành NaHCO3 giúp mình nhé.

Trích mẫu thử 4 mẫu dung dịch.
Dùng quỳ tím thử 4 mẫu thử:
- Quỳ hóa đỏ là: H 2 S O 4 và HCl.
- Quỳ hóa xanh là: B a O H 2 .
- Quỳ không đổi màu là: NaCl.
Dùng B a O H 2 nhận biết 2 dung dịch axit: H 2 S O 4 tạo kết tủa trắng với B a O H 2 , HCl không có hiện tượng.
PTHH: B a O H 2 + H 2 S O 4 → B a S O 4 + 2 H 2 O
⇒ Chọn B.

Dùng dung dịch Ba(OH)2
- Không hiện tượng ➞ NaNO3
- Xuất hiện khí mùi khai và kết tủa trắng ➞ (NH4)2SO4
- Chỉ xuất hiện khí mùi khai ➞ NH4Cl
- Xuất hiện kết tủa trắng không tan trong Ba(OH)2 dư (Mg(OH)2, BaSO4) ➞ MgSO4
- Xuất hiện kết tủa trắng tan một phần trong Ba(OH)2 dư (Al(OH)3, BaSO4) ➞ Al2(SO4)3
- Xuất hiện hỗn hợp kết tủa trắng và trắng xanh (BaSO4, Fe(OH)2) ➞ FeSO4
- Xuất hiện hỗn hợp kết tủa trắng và nâu đỏ (BaSO4, Fe(OH)3) ➞ Fe2(SO4)3
Cho từ từ đến dư Ba(OH)2 vào các dung dịch:
- Al2(SO4)3 tạo kết tủa rồi tan 1 phần:
Al2(SO4)3 + 3Ba(OH)2 \(\rightarrow\) 2Al(OH)3\(\downarrow\) + 3BaSO4\(\downarrow\)
2Al(OH)3 + Ba(OH)2 \(\rightarrow\) Ba(AlO2)2 + 4H2O
- MgSO4 tạo kết tủa trắng không tan:
MgSO4 + Ba(OH)2 \(\rightarrow\) BaSO4\(\downarrow\) + Mg(OH)2\(\downarrow\)
- Fe2(SO4)3 tạo kết tủa màu nâu đỏ:
Fe2(SO4)3 + 3Ba(OH)2 \(\rightarrow\) 3BaSO4\(\downarrow\) + 2Fe(OH)3\(\downarrow\)
- FeSO4 tạo kết tủa trắng xanh hóa nâu trong không khí:
FeSO4 + Ba(OH)2 \(\rightarrow\) BaSO4\(\downarrow\) + Fe(OH)2\(\downarrow\)
4Fe(OH)2 + O2 + 2H2O \(\rightarrow\) 4Fe(OH)3\(\downarrow\)
- (NH4)2SO4 vừa có kết tủa trắng, vừa có khí mùi khai bay ra:
(NH4)2SO4 + Ba(OH)2 \(\rightarrow\) BaSO4\(\downarrow\) + 2NH3\(\uparrow\) + 2H2O
- NH4Cl có khí mùi khai bay ra:
2NH4Cl + Ba(OH)2 \(\rightarrow\) BaCl2 + 2NH3\(\uparrow\) + 2H2O
- Còn lại NaNO3 không có hiện tượng gì.

- Cho giấy quỳ tím tác dụng với các chất trong các lọ
+ QT chuyển xanh: NaOH
+ QT chuyển đỏ: HCl
+ QT không chuyển màu: NaCl, H2O (1)
- Cô cạn (1)
+ Chất lỏng bay hơi,còn lại tinh thể trắng: dd NaCl
+ Chất lỏng bay hơi hoàn toàn: H2O

Trích mỗi chất một ít ra ống nghiệm làm thuốc thử :
Cho quỳ tím lần lượt vào các mẫu thử :
- Hóa đỏ : HCl , H2SO4 (1)
- Hóa xanh : NaOH
- Không HT : NaCl
Cho dd BaCl2 vào (1) :
- Kết tủa trắng : H2SO4
- Không HT : hCl
BaCl2 + H2SO4 => BaSO4 + 2HCl

Lấy mỗi chất một ít làm mẫu thử và đánh số thứ tự
-Nhúng quỳ tím vào từ mẫu thử
+Mẫu thử làm quỳ tím chuyển đỏ là HCl
+Mẫu thử làm quỳ tím chuyển xanh là KOH
+Mẫu thử không làm quỳ tím chuyển màu là Na2SO4,AgNO3
-Nhỏ dung dịch HCl vào từng mẫu thử còn lại
+Mẫu thử xuất hiện kết tủa là AgNO3
+Mẫu thử không có hiện tượng là Na2SO4
PTHH AgNO3+HCl------>AgCl↓+HNO3
Trích mỗi một ít dung dịch cần nhận biết cho vào 4 ống nghiệm có chứa sẵn quỳ tím.
Nếu dd làm quỳ tím chuyển sang màu đỏ thì ống nghiệm đó chứa HCl.
Nếu dd làm quỳ tím chuyển sang màu xanh thì ống nghiệm đó chứa dd KOH.
Nếu dd ko làm đổi màu quỳ tím thì 2 ống ệ còn lại chưa dd Na2SO4, AgNO3.
- Nhỏ vài giọt dd HCl vào 2 ống nghiệm còn lại.
- Nếu xuất hiện kết tủa màu trắng thì ống nghiệm đó chứa dd AgNO3.
AgNO3 + HCl → AgCl↓ + HNO3.
-Ống nghiệm còn lại là Na2SO4

Trích mẫu thử
Cho quỳ tím vào các mẫu thử
- mẫu thử nào chuyển màu đỏ là HCl
- mẫu thử nào chuyển màu xanh là NaOH
- mẫu thử không đổi màu là NaCl
-Lấy 3 mẫu thử của 3 chất vào 3 cốc thủy tinh.
-Lấy quỳ tím nhúng vào 3 cốc:
+ Nếu quỳ tím hóa đỏ thì đó là dd HCl.
+Nếu quỳ tím hóa xanh thì đó là dd NaOH.
+Nếu quỳ tím không đổi màu là dd NaCl.

Trích mẫu thử
Cho quỳ tím vào các mẫu thử
Quỳ tím hóa đỏ=>HCl
Quỳ tím hóa xanh=>NaOH,Ca(OH)2(*)
Quỳ tím k đổi màu=>CuSO4,NaCl(**)
Cho BaSO4 vào (*)
Xuất hiện kết tủa=>Ca(OH)2
pt: BaSO4+Ca(OH)2--->CaSO4+Ba(OH)2
Cho BaCl2 vào (**)
Xuất hiện kết tủa trắng=>CuSO4
pt: CuSO4+BaCl2--->CuCl2+BaSO4