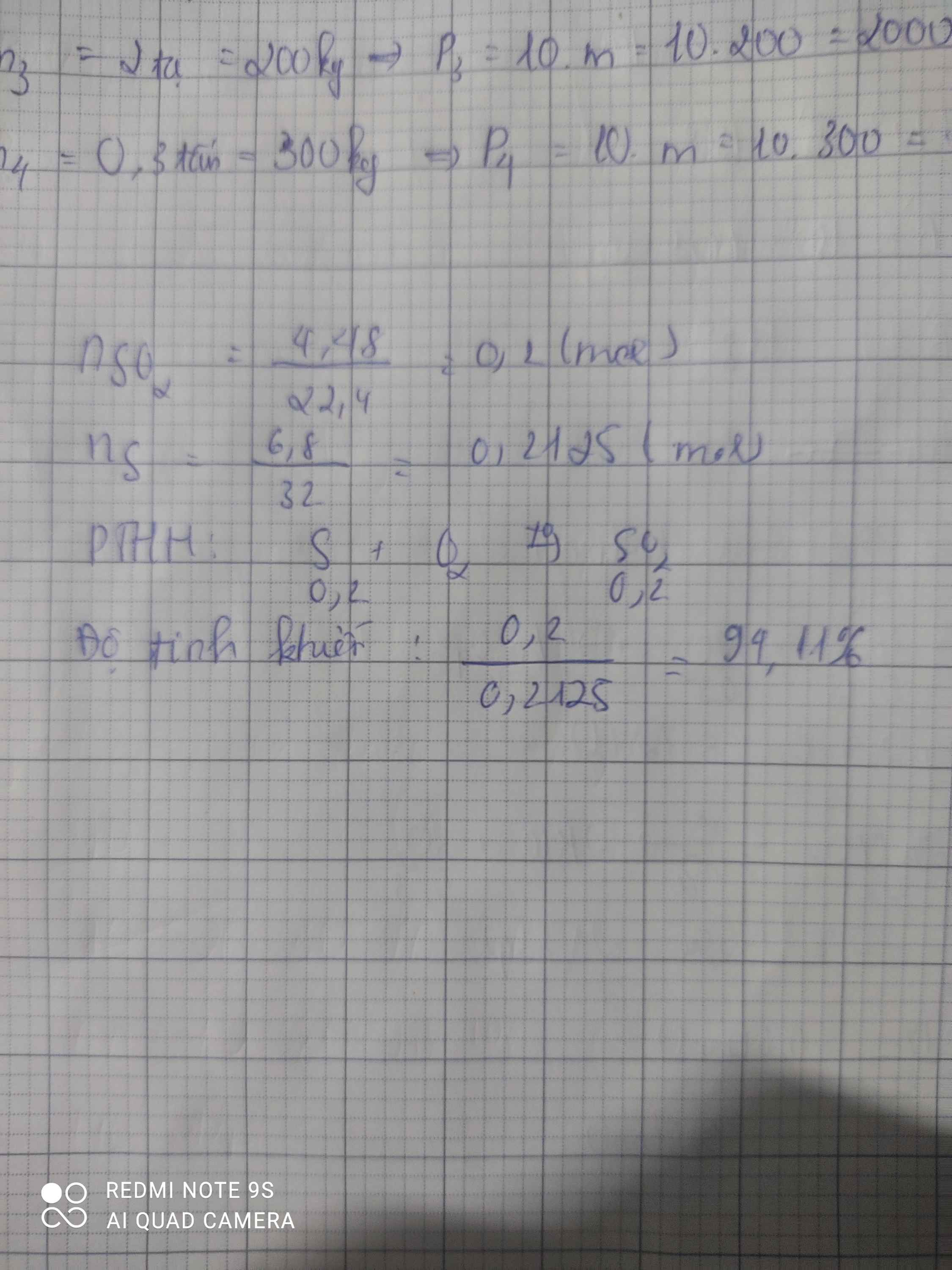Đốt cháy 6,5 gam lưu huỳnh ko tinh khiết trong khí oxi dư thu đc 4,48 lít khí SO2 (đktc). Tính độ độ tinh khiết của mẫu lưu huỳnh trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,1<--------------0,1
=> \(\%S=\dfrac{32.0,1}{3,4}.100\%=94,12\%\)
=> B

nS =nSO2=0,2 mol
mS= 6,4 gam
độ tinh khiết = 6,4/6,8=94,12%

a) S + O2 \(\rightarrow\) SO2
b) Tính độ tinh khiết bằng cách lấy lượng lưu huỳnh tinh khiết(tức là lượng lưu huỳnh tham gia phản ứng ) chia cho lượng lưu huỳnh đề bài cho nhân với 100% . Mình giải luôn nhé!
nSO2 = V/22,4 = 2,24/22,4 =0,1(mol)
Theo PT => nS = nSO2 = 0,1(mol)
=> mS(tinh khiết) = n .M = 0,1 x 32 = 3,2(g)
=> độ tinh khiết của mẫu lưu huỳnh đã dùng = mS(tinh khiết) : mS(ĐB) x 100% = 3,2/3,25 x 100% =98,46%
c) Theo PT thấy nO2 = nSO2
mà số mol = nhau dẫn đến thể tích cũng bằng nhau
=> VO2 = VSO2 = 2,24(l)

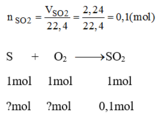
Theo pt: 1 mol S tham gia phản ứng sinh ra 1 mol S O 2
Số mol của lưu huỳnh tham gia phản ứng:
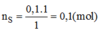
Khối lượng của lưu huỳnh tinh khiết: m S = n S . M S =0,1.32=3,2(g)
Độ tinh khiết của mẫu lưu huỳnh:
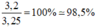

Theo pt 1 mol O 2 phản ứng sinh ra 1 mol S O 2
Tỉ lệ thể tích cũng chính là tỉ lệ về số mol nên thể tích O 2 thu được 2,24 lít

Đốt cháy 6,5 g lưu huỳnh không tinh khiết trong khí oxi dư,thu được 4,48 l khí SO2(đktc)
a,Viết PTHH của phản ứng
b,tính thể tích khí O2 dã phản ứng(đktc)
c,tính độ tinh khiết của mẫu lưu huỳnh trên
giải
a/\(S+O_2----->SO_2\)
b/nS=\(\dfrac{m}{M}=\)\(\dfrac{6,5}{32}=0,2\)mol
thep pthh ta có nS=nO2=0,2(mol)
Thể tích của khí oxi là :
VO2=n.22,4=0,2.22,4=4,48(lít)
Bạn tham khảo a;b thôi nhé c mik ko hỉu lắm
Biết rùi!!!!
c/nS=0,2(mol)
mS=0,2.32=6.4(gam)
VẬY ĐỘ TINH KHIẾT CỦA LƯU HUỲNH LÀ \(\dfrac{6,4}{6,5}.100\%=98,46\%\)
thế r ok bài

\(n_{CO_2}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_C=n_{CO_2}=0,8\left(mol\right)\)
\(\Rightarrow m_C=0,8.12=9,6\left(g\right)\)
Độ tinh khiết của mẫu C là: \(\dfrac{9,6}{15}.100\%=64\%\)