Nung nóng 23,4 gam Fe(NO3)2 (trong điều kiện không có không khí) với hiệu suất phản ứng là 90%. Tính khối lượng chất rắn thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Sửa đề : 13,17 → 13,16
Gọi \(n_{Cu(NO_3)_2\ pư} = a(mol)\)
\(2Cu(NO_3)_2 \xrightarrow{t^o} 2CuO + 4NO_2 + O_2\\ n_{CuO} = n_{Cu(NO_3)_2\ pư} = a(mol)\\ \Rightarrow m_{chất\ rắn\ sau\ pư} = m_{CuO} + m_{Cu(NO_3)_2\ dư}\\ \Rightarrow 8,36 = 80a + 13,16 - 188a\\ \Rightarrow a = \dfrac{2}{45}\\ H = \dfrac{\dfrac{2}{45}.188}{13,16}.100\% = 63,49\%\)

2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Sau phản ứng cho hỗn hợp rắn tác dụng với dd NaOH thấy có khí thoát ra, suy ra có Al dư.
Vậy hỗn hợp rắn: Fe, A l 2 O 3 , Al (dư) và F e 2 O 3 (nếu dư).
Theo định luật bảo toàn khối lượng, ta có:
m X = m r ắ n tan + m r ắ n k h ô n g tan
= 21,67 - 12,4 = 9,27g
Mà m r ắ n tan = m A l d u + m A l 2 O 3
2Al + 2NaOH + 2 H 2 O
→ 2 N a A l O 2 + 3 H 2 1
Theo PTHH (1), ta có:
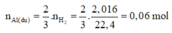
⇒ m A l d u = 0,06.27 = 1,62g
⇒ m A l 2 O 3 p u = m r a n tan - m A l d u
= 9,27-1,62=7,65 g
⇒ n A l 2 O 3 p u = 0,075mol
⇒ n A l p u = n F e s p = 2 n A l 2 O 3 p u
= 0,075.2 = 0,15 mol
Ta có:
m ran khong tan = mFe (sp) = mFe2O3(neu dư)
⇒ m F e 2 O 3 (neu dư)=12,4-0,15.56 = 4g
⇒ n F e 2 O 3 dư = 4/160 = 0,025 mol
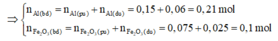
Giả sử phản ứng hoàn toàn thì Al sẽ dư → Tính hiệu suất phản ứng nhiệt nhôm theo F e 2 O 3 .
⇒ H = 0,075.100/0,1 = 75%
⇒ Chọn D.

Coi :
\(m_A = 232(gam)\\ \Rightarrow n_{Fe_3O_4} = 232.90\% : 232 = 0,9(mol)\\ \text{Gọi hiệu suất phản ứng là a}\Rightarrow n_{Fe_3O_4\ pư} = 0,9a(mol)\\ Fe_3O_4 + 4H_2 \xrightarrow{t^o} 3Fe + 4H_2O\\ n_{Fe} = 0,9a.3 = 2,7a(mol)\\ n_{Fe_3O_4\ dư} = 0,9 - 0,9a(mol)\\ m_B = 2,7a.56 + (0,9 - 0,9a).232 = 232.80\%\\ \Rightarrow a = 0,4028 = 40,28\%\)

Câu 7 :
1) \(n_{Fe3O4}=\dfrac{34,8}{232}=0,15\left(mol\right)\)
Pt : \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O|\)
1 4 3 4
0,15 0,45
\(n_{Fe}=\dfrac{0,15.3}{1}=0,45\left(mol\right)\)
\(m_{Fe\left(Lt\right)}=0,45.56=25,2\left(g\right)\)
⇒ \(m_{Fe\left(tt\right)}=25,2.90\%=22,68\left(g\right)\)
Chúc bạn học tốt
\(n_{Fe_3O_4}=\dfrac{34,8}{232}=0,15\left(mol\right)\)
\(pthh:Fe_3O_4+H_2\underrightarrow{t^o}Fe+H_2O\)
0,15 0,15
=> \(m_{Fe}=\dfrac{90.0,15}{100}.56=7,56\left(g\right)\)

Chọn đáp án A
mCu tối đa = 0,2´0,75´64 = 9,6 gam và mFe tối đa = 0,2´56 = 11,2 gam
Vì 9,6 + 11,2 > 14,08 Þ Fe2+ dư, Mg và Al bị oxi hóa hết Þ nFe trong Y = (14,08 – 9,6)/56 = 0,08
Đặt nMg = 4a Þ nAl = a; BTE Þ 2´4a + 3a = 0,2 + 0,15´2 + 0,08´2 Þ a = 0,06
Þ Trong X chứa 0,24 mol Mg2+ + 0,06 mol Al3+ + 0,12 mol Fe2+
Þ Chất rắn sau cùng gồm: 0,24 mol MgO và 0,06 mol Fe2O3
Vậy mChất rắn = 0,24´40 + 0,06´160 = 19,2 gam

Đáp án D
2 Al + Fe 2 O 3 → t o Al 2 O 3 + 2 Fe
Hỗn hợp sau phản ứng gồm A12O3, Fe, Al và Fe2O3.
Khi cho hỗn hợp vào dung dịch NaOH dư thì chỉ có Al và A12O3 tan, chất rắn còn lại gồm Fe và Fe2O3

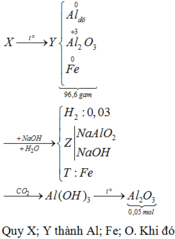
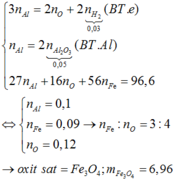

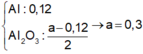
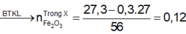
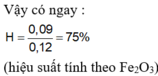
\(Fe\left(NO_3\right)_2--->Fe_2O_3+NO_2+O_2\)
Bảo toàn nguyên tố Fe :
\(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(NO_3\right)_2}.90\%=\dfrac{1}{2}.\dfrac{23,4}{180}.90\%=0.065.90\%=0.0585\left(mol\right)\)
⇒ mCR = 9.36(g)