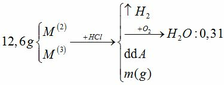
1) Hòa tan 18.4g hỗn hợp hai kim loại hóa trị II và III bằng axit HCl thu được dung dịch A và khí B. Chia B thành hai phần bằng nhau.
a) Phần 1: Đem đốt cháy thu được 4.5 gam nước. Hỏi cô cạn dung dịch A thu được bao nhiêu gam muối khan.
b) Phần 2: Tác dụng hết với clo sau đó hòa tan vào nước, dung dịch thu được cho hấp thụ vào 200ml dd NaOH 20% ( D= 1.2g/ml). Tính nồng độ phần trăm các chất trong dung dịch tạo ra.
c) Tìm 2 kim loại, nếu biết tỉ số mol 2 muối khan= 1:1 và khối lượng mol của kim loại này gấp 2.4 lần khối lượng mol của kim loại kia.
2) Hòa tan hoàn toàn 4.06 gam hỗn hợp Al, Fe, Zn vào trong dd H2SO4 loãng thu được khí A và dung dịch B. Cho khí A đi qua vôi sống để làm khô khí, sau đó cho tiếp qua 12 gam CuO nung nóng, cuối cùng đi qua H2SO4 đặc. Sau thí nghiệm bình đựng H2SO4 đặc tăng thêm 1.98 gam.
Cho dung dịch B tác dụng với dug dịch NaOH dư, lọc lấy kết tủa rồi nung kết tủa đến khối lượng không đổi, thu được 2.4 gam chất rắn.
Viết các phương trình phản ứng xảy ra và tính thành phần % các kim loại trong hỗn hợp, biết rằng các phản ứng đều có hiệu suất 100%.
3) Lấy một hỗn hợp bột Al và Fe2O3 đem thực hiện phản ứng nhiệt nhôm trong điều kiện không có không khí. Sau khi phản ứng kết thúc hoàn toàn thì được một hỗn hợp chất rắn A. Chia A thành hai phần bằng nhau và thực hiện các thí nghiệm:
Thí nghiệm 1: Lấy phần 1 cho tác dụng với dung dịch KOH 2M thì được 10.08 lít khí H2(đktc)
Thí nghiệm 2: Lấy phần 2 cho tác dụng với 500ml dung dịch H2SO4 thì được dd B và 20.16 lít khí H2 ( đktc)
a) Tính thành phần % Al và Fe3O4 trong hỗn hợp.
b) Tính thể tích dung dịch KOH 2M dùng cho thí nghiệm 1.
c) Tính nồng độ mol/l của dung dịch H2SO4 dùng cho thí nghiệm 2.
Mọi người giúp em mấy bài này với ạ. Em cảm ơn.

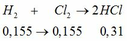
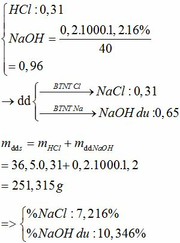
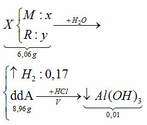
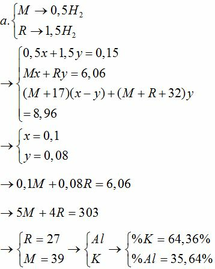
1 a) Gọi kim loại hóa tri II và III lần lượt là A và B
Gọi số mol của A và B lần lượt là x và y
nH2O = 4,5 : 18 = 0,25 (mol)
PTHH:
A + 2HCl \(\rightarrow\)ACl2 + H2 (1)
x 2x x x 2B + 6HCl \(\rightarrow\)2BCl3 + 3H2 (2)
y 3y y 3/2y
2H2 + O2 \(\rightarrow\) 2H2O (3)
0,25 0,25
Từ đầu bài ta có Ax + By = 18,4 (1’)
Vì chỉ ½ B đem đốt nên
Theo (1,2) có x/2 + 3/4y = 0,25 \(\rightarrow\) 2x + 3y = 1 (2’)
Khối lượng muối khan = (A + 35,5.2)x + (B + 35,5.3)y (thế 1’và 2’) = Ax + By + 35,5(2x +3y) = 53,9 (g)
b) H2 + Cl2 \(\rightarrow\) 2HCl 0,25 0,5
HCl + NaOH \(\rightarrow\)NaCl + H2O
0,5 0,5 0,5
Ta có mNaOH(dd) = 1,2.200 = 240 (g)
\(\rightarrow\)mNaOH = (240.20)/100=46 (g)
\(\rightarrow\)nNaOH = 1,15 (mol)
Vậy NaOH dư là 1,15 – 0,5 = 0,65 (mol) => mNaOH (dư) = 26 (g)
%NaOH = (26: 240).100 = 10,8%
mNaCl = 29,25 (g)
%NaCl = (29,25 :240).100 = 12,18%
c) Muối là ACl2 và BCl3 có số mol bằng nhau, giả sử cùng là a mol
nCl trong muối = 2a + 3a =5a phải bằng nCl trong HCl đã pứ. vậy 5a=0.5 -> a=0.1
Khối lượng kim loại trong 1/2 hh là 18.4 /2 = 9.2 gam -> Xa +Ya =9.2 X+Y = 92
mặt khác ta có khối lượng mol kim loại này gấp 2.4 lần khối lượng mol của kim lọai kia vậy ta có hoặc X/Y = 2.4 hoặc Y/X = 2.4
bạn sẽ thấy hệ :
X+Y = 92
X/Y = 2.4
cho nghiệm X = 65, Y= 27 -> X là Zn, Y là Al (thỏa mãn)