Cho m gam kim loại M hoà tan hoàn toàn trong 100 ml dung dịch HCl 0,1M (D= 1,05 g/ml) được dd X có khối lượng là 105,11 gam . Xđ m và M biết kim loại M có hoá trị I đến III
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khối lượng dung dịch HCl :
m dd = V x D = 100 x 1,05 = 105 (gam)
n HCl = 0,1 x 0,1 = 0,01 (mol)
Gọi hoá trị của kim loại M là n
Phương trình hoá học của phản ứng :
2M + 2nHCl → 2 MCl n + n H 2 (1)
Áp dụng định luật bảo toàn khối lượng
m + m HCl = m muối + m H 2
m = 105,11 + 0,01/2 x 2 - 105 = 0,12g
Theo phương trình hóa học (1) :
n M = 0,01/n mol → 0,01/n x M = 0,12 → M = 12n
Kẻ bảng
| n | 1 | 2 | 3 |
| M | 12 | 24 | 36 |
| loại | nhận | loại |
Vậy kim loại M là Mg.

a, \(n_{HCl}=0,1.0,1=0,01\left(mol\right)\)
\(m_{ddHCl}=100.1,05=105\left(g\right)\)
BTNT H, có: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,005\left(mol\right)\)
Theo ĐLBT KL, có: mM + m dd HCl = m dd sau pư + mH2
⇒ mM = 105,11 + 0,005.2 - 105 = 0,12 (g) = m
Giả sử M có hóa trị n.
BT e, có: n.nM = 2nH2 \(\Rightarrow n_M=\dfrac{2n_{H_2}}{n}=\dfrac{0,01}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{0,12}{\dfrac{0,01}{n}}=12n\left(g/mol\right)\)
Với n = 2, MM = 24 (g/mol) là thỏa mãn.
Vậy: M là Mg.
b, Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{0,26}{65}=0,004\left(mol\right)\\n_{Fe}=\dfrac{0,28}{56}=0,005\left(mol\right)\end{matrix}\right.\)
\(n_{HCl}=0,2.0,1=0,02\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
____0,004_____0,008__0,004 (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,005____0,01____0,005 (mol)
⇒ nHCl (dư) = 0,02 - 0,008 - 0,01 = 0,002 (mol)
Sau pư trong dd còn: \(\left\{{}\begin{matrix}ZnCl_2:0,004\left(mol\right)\\FeCl_2:0,005\left(mol\right)\\HCl:0,002\left(mol\right)\end{matrix}\right.\)
- Cho Mg vào đến khi thu dd có chứa 2 muối (MgCl2 và ZnCl2):
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
__0,001______0,002 (mol)
\(Mg+FeCl_2\rightarrow MgCl_2+Fe\)
0,005_____0,005___________0,005 (mol)
\(Mg+ZnCl_2\rightarrow MgCl_2+Zn\)
x_________x_______________x (mol)
B gồm: 0,005 (mol) Fe và x (mol) Zn
Mà: mB - mMg = 0,218
⇒ 0,005.56 + 65x - (0,001 + 0,005 + x).24 = 0,218
⇒ x = 0,002 (mol)
⇒ mMg pư = (0,001 + 0,005 + 0,002).24 = 0,192 (g)

Đáp án C.
Gọi nguyên tử khối của kim loại M cũng là M, có hóa trị là x, ta có:
n M = 18/M (mol); n HCl = 0,8 x 2,5 = 2 mol
Phương trình hóa học
2M + 2xHCl → 2 MCl x + x H 2
Có: 18/M x 2x = 4 → M = 9x
Xét bảng sau
| X | I | II | III |
| M | 9 | 18 | 27 |
Chỉ có kim loại hóa trị III ứng với M = 27 là phù hợp, kim loại M là nhôm (Al)

Câu 1.
(1) \(2Fe+3Cl_3\underrightarrow{t^o}2FeCl_3\)
(2) \(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaCl\)
(3) \(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
(4) \(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
Câu 2.
Khối lượng dd HCl là:
\(m_{dd}=V\cdot D=100\cdot1,05=105\left(g\right)\)
\(\rightarrow n_{HCl}=0,1\cdot0,1=0,01\left(mol\right)\)
Gọi hóa trị của kim loại M là x
PTHH:
2M + 2xHCl ---> 2MClx + xH2
\(\frac{0,01}{x}\)__ 0,01______\(\frac{0,01}{x}\)___\(\frac{0,01}{2}\) (mol)
Áp dụng định luật bảo toàn khối lượng:
m + mHCl = mmuối + m\(H_2\)
\(m=105,11+\frac{0,01}{2}\cdot2-105=0,12\left(g\right)\)
Theo pt: \(n_M=\frac{0,01}{2}\rightarrow\frac{0,01}{x}\cdot M=0,12\rightarrow M=12x\)
Kẻ bảng:
| n |
1_______2________3 |
| M |
12_____24_______36 (loại)_(nhận)____(loại) |
Vậy kim loại M là Mg
Câu 3.
Gọi kí hiệu và nguyên tử khối của kim loại là M.
PTHH:
2M + Cl2 -------> 2MCl
2M (g)________2(M + 35,5) (g)
9,2 (g)_________23,4 (g)
\(9,2\cdot2\left(M+35,5\right)=2M+23,4\)
\(\Leftrightarrow653,2=28,4M\)
\(\Leftrightarrow M=23\)
Vậy kim loại M là Na
Câu 1:
PTHH: 2Fe + 3Cl2 \(\underrightarrow{t^o}\) 2FeCl3
FeCl3 + 3NaOH \(\rightarrow\) Fe(OH)3\(\downarrow\) + 3NaCl
2Fe(OH)3 \(\underrightarrow{t^o}\) Fe2O3 + 3H2O
Fe2O3 + 3CO \(\underrightarrow{t^o}\) 2Fe + 3CO2\(\uparrow\)

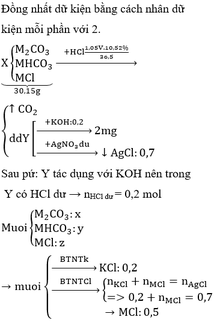
Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
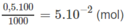
Số mol NaOH trong 33,4 ml nồng độ 1M :
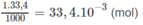
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 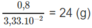
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.

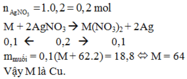
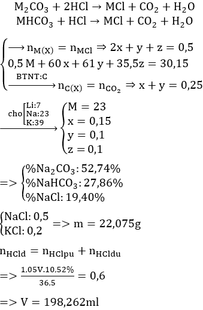
m(ddHCl) = D * V = 1,05 * 100 = 105 (g)
nHCl = \(\frac{100\cdot0,1}{1000}\)= 0,01 (mol)
gọi hóa trị của kim loại M cần tìm là n
2M + 2nHCl → 2MCln + nH2
(mol) 0,01/n ← 0,01 → 0,005
mH2 = 0,005 * 2 = 0,01 (g)
m(ddsau) = mM + m(ddHCl) - mH2
⇒ mM = m(ddsau) - m(ddHCl) + mH2
= 105,11 - 105 + 0,01
= 0,12 (g)
⇒M (M) = mM / nM = 0,12 / (0,01/n) = 12n
với n = 1 suy ra M = 12 (loại)
với n = 2 thì M = 24 (Mg)
với n = 3 thì M = 36 (loại)
Vậy m(M) = 0,12 (g)
M là Magie