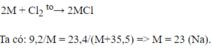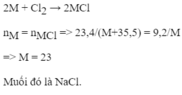Cho 9,2g một kim loại A tác dụng bởi khí Cl dư, tạo ra 23,4g muối. Tìm kim loại A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



2A+Cl2->2ACl
nA=nACl
mA/mACl=MA/MA+35.5
Theo bài ra:mA:mACl=9.2:23.4
->MA/MA+35.5=9.2/23.4
->MA=23(g/mol)->A là Natri
theo đề bài, khí là Cl2
gọi Kim loại đó là A
PTK của nó là MA
số mol của nó là a
PT: 2A+CL2=>2ACl
nACl=nA=a
theo bài ra ta có :
MA*a=9,2
(MA+35,5)*a=23,4
giải hệ này ra sẽ tính được a=0,4
từ đó tính được PTK của kim loại = 23 => đó là Na

Gọi a là số mol khí Clo phản ứng
Phương trình phản ứng
\(Cl_2+2X\rightarrow2XCl\)
a------>2a------->2a
.........\(\dfrac{9,2}{M_X}\)......\(\dfrac{23,4}{M_X+35,5}\)
Từ phương trình ta thấy số mol của Kim loại và muối bằng nhau nên:
=> 9,2MX + 326,6 = 23,4MX
=> 326,6 = 14,2MX
=> MX =23 ( là kim loại Na )
Vậy kim loại đó là Natri
Muối của kim loại là NaCl
Giải:
Gọi kim loại hóa trị I là A
PTHH: 2A + Cl2 ----> 2ACl
Theo định luật bảo toàn khối lượng:
mA + m\(Cl_2\)= m\(ACl\)
=> m\(Cl_2\)= \(m_{ACl}-m_A\)= \(23,4-9,2=14,2\left(gam\right)\)
=> n\(Cl_2\) = \(\dfrac{14,2}{71}=0,2\left(mol\right)\)
Theo PTHH: nA= 2n\(Cl_2\) = 2.0,2 = 0,4 (mol)
MA = \(\dfrac{9,2}{0,4}\)= 23 (g/mol)
=> Kim loại hóa trị I là: Na
=> Muối của kim loại là: NaCl