hỗn hợp X gồm 2 chất rắn FeCO3 và FeS2. cho X cùng với 1 lượng oxi vào bình kín dung tích V(l). đốt nóng cho phản ứng xảy ra hoàn toàn (giả thiết 2 phản ứng xảy ra như nhau và sản phẩm thu được là Fe2O3) sau phản ứng đưa bình về nhiệt độ ban đầu thu được chất rắn Y và hỗn hợp khí Z.áp suất ttrong bình lúc này là p. để hoà tan chất rắn Y cần 200 ml dd HCl 0,3M thu được hỗn hợp kkhis M và sản phẩm E còn lại, nếu đưa M vào bình kín dung tích V lít ở cùng điều kiện với Z thì áp suất lúc này là p/2. thêm NaOH dư vào vào sản phẩm E được chất rắn F, lọc lấy F và làm khô trong không khí thu được 3,85g (không nung)viết ptpu tính khối lượng các muối trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

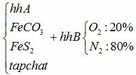
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
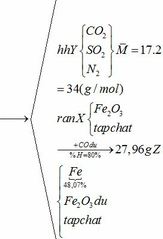
Vậy hỗn hợp Y gồm:
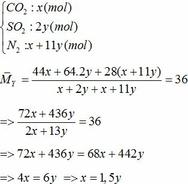
Khối lượng Fe có trong Z là:
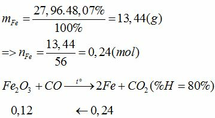
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
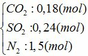
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
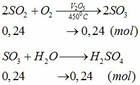
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
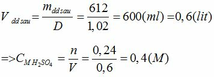

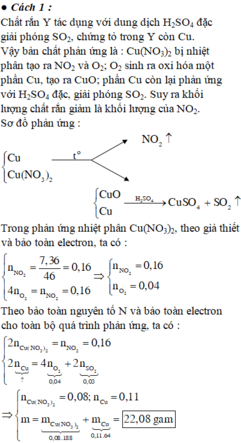
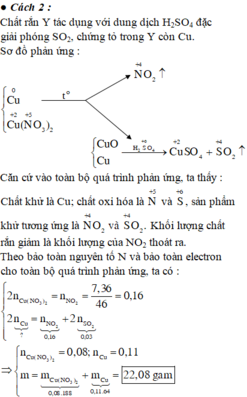
Do Y tác dụng với H 2 S O 4 tạo S O 2 nên Y có Cu.
Do đó khối lượng chất rắn giảm là khối lượng của N O 2

Đáp án là D