Hấp thụ hoàn toàn 0,15 mol CO2 vào dung dịch chứa 0,2 mol Ca(OH)2 Sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa, tính giá trị của m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Okay em đề là Ca(OH)2
\(T=\dfrac{2.n_{Ca\left(OH\right)_2}}{n_{CO_2}}=\dfrac{2.0,2}{0,15}\approx2,67>2\)
=> Sản phẩm thu được duy nhất CaCO3 . Dung dịch Ca(OH)2 dư.
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\\ n_{CaCO_3}=n_{CO_2}=0,15\left(mol\right)\\ \Rightarrow m_{\downarrow}=m_{CaCO_3}=0,15.100=15\left(g\right)\)
Em kiểm tra lại đề nha, NaOH thì sẽ không tạo kết tủa với CO2
Check lại xem Ca(OH)2 hay Ba(OH)2 nha em!
Cảm ơn em

$n_{CaCO_3} = \dfrac{13}{100} = 0,13(mol)
TH1 : $Ca(OH)_2$ dư
$Ca(OH)_2 + CO_2 \to CaCO_3 + H_2O$
$n_{CO_2} = x = n_{CaCO_3} = 0,13(mol)$
TH2 : Có tạo muối axit
\(Ca\left(OH\right)_2+CO_2\text{→}CaCO_3+H_2O\)
0,13 0,13 0,13 (mol)
\(Ca\left(OH\right)_2+2CO_2\text{→}Ca\left(HCO_3\right)_2\)
0,07 0,14 (mol)
$n_{CO_2} = x = 0,13 + 0,14 = 0,27(mol)$

Dung dịch thu được a gam , ý là gam chất tan hay sao nhỉ? Đề này mình thấy cách diễn đạt bị khó hiểu

Đáp án : B
,nCO2 bđ = 0,4 mol
100 ml X + Ba(OH)2 -> nBaCO3 = nC(X) = 0,2 mol
=> Trong 400 ml X có 0,8 mol C => Bảo toàn C : nCO2 bđ + nK2CO3 = nC(X)
=> nK2CO3 = y = 0,4 mol
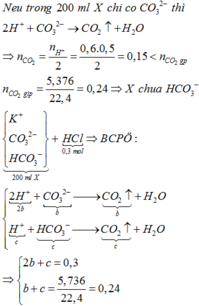
Giả sử trong 200 ml X có a mol K2CO3 và b mol KHCO3 ( a + b = 0,4 mol)
Cho từ từ X vào nHCl = 0,3 mol tạo nCO2 = 0,24 mol
=> K2CO3 và KHCO3 phản ứng đồng thời (vì HCl lúc đầu dư) theo tỉ lệ mol a : b
Gọi nK2CO3 pứ = ax và nKHCO3 pứ = bx
=> 2ax + bx = nHCl = 0,3 mol ; ax + bx = nCO2 = 0,24 mol
=> ax = 0,06 và bx = 0,18 mol
=> a : b = 1 : 3
=> a = 0,1 ; b = 0,3 mol
=> Bảo toàn K : x + 2y = 2.(2a + b)
=> x = 0,2 mol
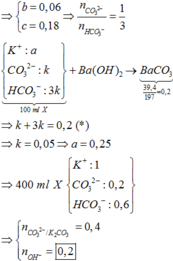


\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
Lập tỉ lệ : \(\dfrac{0,15}{1}< \dfrac{0,2}{1}\)
=> Sau phản ứng Ca(OH)2 dư
\(n_{CaCO_3}=n_{CO_2}=0,15\left(mol\right)\)
=> \(m_{CaCO_3}=0,15.100=15\left(g\right)\)