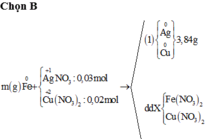
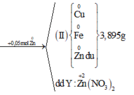
Cho 0,405 gam kim loại M dạng bột ( có hóa trị III trong hợp chất ) vào 150 ml dung dịch chứa đồng thời AgNO3 0,2M và Cu (NO3)2 0,1M . Sau khi phản ứng kết thúc thu được 3,72 gam chất rắn và dung dịch X .
a, Xác định kim loại M
b, Cho V ml dung dịch chứa đồng thời Ba (OH)2 2M ; NaOH 1M vào dung dịch X thu được lượng kết tủa lớn nhất . Tính V


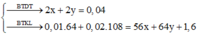

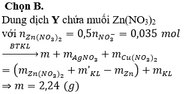
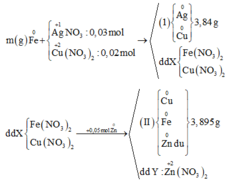

a, Vì Ag đứng ngay sau Cu trong dãy hoạt động
=> M phản ứng với cả 2 dd, phản ứng với dd Ag trước dd Cu sau
PTHH
\(M+3AgNO_3\) \(\rightarrow\)\(M\left(NO_3\right)_3+3Ag\) (1)
0,03 0,03 0,03 mol
\(2M+3Cu\left(NO_3\right)_2\)\(\rightarrow\)\(2M\left(NO_3\right)_3+3Cu\) (2)
\(n_{AgNO_3}=0,2.0,15=0,03\) mol
\(n_{Cu\left(NO_3\right)_2}=0,1.0,15=0,015\) mol
Theo pt (1) \(n_{Ag}=n_{AgNO_3}=0,03\) mol => \(n_{M\left(1\right)}=\dfrac{1}{3}n_{Ag}=0,01\) mol
=> \(m_{Ag}=0,03.108=3,24g\)
=>\(m_{Cu\left(pt2\right)}=3,72-3,24=0,48g\)
=> \(n_{Cu}=\dfrac{0,48}{64}=0,0075\) mol
=> \(n_{M\left(2\right)}=\dfrac{2}{3}n_{Cu}=0,005\) mol
=> \(n_M=0,005+0,01=0,015\) mol
=> \(M_M=\dfrac{m}{n}=\dfrac{0,405}{0,015}=27\) (g/mol)
=> M là Nhôm ( Al )