Người ta đốt một hidrocacbon bằng O2 dư rồi dẫn sản phẩm cháy đi lần lượt qua H2SO4 đặc rồi đến 300ml dd NaOH 2M thu được dd A. Khi thêm BaCl2 dư vào dd A thấy thoát ra 39,4g kết tủa BaCO3 còn lượng H2SO4 tăng thêm 10,8g. Hỏi hidrocacbon trên là chất nào.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


m H2O = m bình 1 tăng = 21,6(gam)
=> n H2O = 21,6/18 = 1,2(mol)
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
n CO2 = n CaCO3 = 100/100 = 1(mol)
Bảo toàn nguyên tố C,H :
n C = n CO2 = 1(mol)
n H = 2n H2O = 1,2.2 = 2,4(mol)
n C : n H = 1 : 2,4 = 5 : 12
Suy ra :CTP là (C5H12)n
Ta có :
M X = (12.5 + 12)n = 32.2,25
=> n = 1
Vậy CTPT là C5H12

Khối lượng bình 2 tăng = mCO2 = 35,2 gam
=> nCO2 = \(\dfrac{35,2}{44}\) = 0,8 mol , nO2 = \(\dfrac{28}{22,4}\) = 1,25 mol
A + O2 → CO2 + H2O
Áp dụng định luật BTNT O => 2nO2 = 2nCO2 + nH2O
=> nH2O = 1,25.2 - 0,8.2 = 0,9 mol
Ankan có CTPT CnH2n+2: x mol
Ankađien có CTPT CmH2m-2 : y mol
CnH2n+2 + O2 → nCO2 + (n+1)H2O
x x.n x.(n+1)
CmH2m-2 + O2 → mCO2 + (m-1)H2O
y y.m y(m-1)
Ta có nH2O - nCO2 = y(m-1) + x.(n+1) - x.n - y.m = x - y = 0,1 (1)
Mà x + y = 0,3 (2)
Từ (1), (2) => x = 0,2 và y = 0,1
%V Ankađien = \(\dfrac{0,1}{0,3}.100\%\)= 33,34%

Đáp án A
Khối lượng bình 1 tăng là khối lượng của H2O => nH2O = 1,8/18 = 0,1 mol
Khối lượng bình 2 tăng là khối lượng của CO2 => nCO2 = 3,52/44 = 0,08 mol
Nhận thấy: nCO2 < nH2O => hidrocacbon là ankan;
Số mol ankan là nankan = 0,1 – 0,08 = 0,02 mol
Phương trình phản ứng:
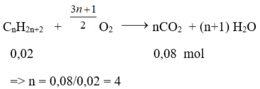
CTPT của A là C4H10

$n_{NaOH} = 0,2.2,5 = 0,5(mol)$
$BaCl_2 + Na_2CO_3 \to BaCO_3 + 2NaCl$
$n_{Na_2CO_3} = n_{BaCO_3} = \dfrac{39,4}{197} = 0,2(mol)$
TH1 : có tạo muối axit
$CO_2 + 2NaOH \to Na_2CO_3 + H_2O$
$CO_2 + NaOH \to NaHCO_3$
Suy ra:
$n_{NaHCO_3} = n_{NaOH}- 2n_{Na_2CO_3} = 0,5 - 0,2.2 = 0,1(mol)$
$n_{CO_2} = n_{Na_2CO_3} + n_{NaHCO_3} = 0,3(mol)$
$MgCO_3 + 2HCl \to MgCl_2 + CO_2 + H_2O$
$RCO_3 + 2HCl \to RCl_2 + CO_2 + H_2O$
$n_{MgCO_3} = n_{RCO_3} = \dfrac{0,3}{2} = 0,15(mol)$
Suy ra:
$0,15.84 + 0,15.(R + 60) = 20 \Rightarrow R = -10,6 \to$ Loại
TH2 : NaOH dư
$2NaOH + CO_2 \to Na_2CO_3 + H_2O$
$n_{CO_2} = n_{Na_2CO_3} = 0,2(mol)$
$n_{MgCO_3} = n_{RCO_3} = \dfrac{0,2}{2} = 0,1(mol)$
$\Rightarrow 0,1.84 + 0,1(R + 60) = 20 \Rightarrow R = 56(Fe)$
$\%m_{MgCO_3} = \dfrac{0,1.84}{20}.100\% = 42\%$
$\%m_{RCO_3} = 100\% -42\% = 58\%$

Ta có: \(n_{H_2O}=\dfrac{14,4}{18}=0,8\left(mol\right)\)
\(n_{CO_2}=n_{CaCO_3}=\dfrac{60}{100}=0,6\left(mol\right)\)
⇒ nH2O > nCO2 → A là ankan.
⇒ nA = nH2O - nCO2 = 0,2 (mol)
CTPT của A là CnH2n+2
\(\Rightarrow n=\dfrac{n_{CO_2}}{n_A}=3\)
Vậy: CTPT của A là C3H8.

Đáp án B.
n C O 2 = 1 m o l ; Bình 1 chỉ giữ H2O ở lại mà polietilen
n C O 2 = n H 2 O ⇒ m H 2 O = 1 : 18 = 18 gam
\(n_{NaOH}=0,3.2=0,6mol\)
CxHy+(x+y/4)O2\(\rightarrow\)xCO2+(y/2)H2O
-Bình H2SO4 bắt H2O\(\rightarrow\)\(m_{H_2O}=10,8g\rightarrow n_{H_2O}=\dfrac{10,8}{18}=0,6mol\)
\(n_{BaCO_3}=\dfrac{39,4}{197}=0,2mol\)
-Trường hợp 1: CO2+2NaOH\(\rightarrow\)Na2CO3+H2O
Na2CO3+BaCl2\(\rightarrow\)BaCO3+2NaCl
\(n_{CO_2}=n_{Na_2CO_3}=n_{BaCO_3}=0,2mol\)
-Ta có: \(\dfrac{x}{0,2}=\dfrac{\dfrac{y}{2}}{0,6}\rightarrow6x=y\)
y=6x\(\le\)2x+2\(\rightarrow\)4x\(\le2\rightarrow x\le1\rightarrow x=1\)\(\rightarrow\)y=6(không phù hợp)
-Trường hợp 2:
CO2+2NaOH\(\rightarrow\)Na2CO3+H2O
0,2......0,4.........\(\leftarrow\)0,2
CO2+NaOH\(\rightarrow\)NaHCO3
0,2\(\leftarrow\)0,6-0,4
Na2CO3+BaCl2\(\rightarrow\)BaCO3+2NaCl
0,2......................\(\leftarrow\)0,2
\(n_{CO_2}=0,2+0,2=0,4mol\)
\(\dfrac{x}{0,2}=\dfrac{\dfrac{y}{2}}{0,4}\rightarrow\dfrac{x}{y}=\dfrac{1}{4}\)
CTPT:CH4:Metan