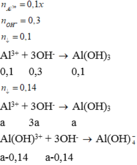Thêm 150 ml dung dịch NaOH 2M vào cốc đựng 100ml dung dịch AlCl3 x mol/l khuấy đều đén khi phản ứng xảy ra hoàn toàn thấy có 0,1 mol kêt tủa. Thêm tiếp 100ml dung dịch NaOH 2M vào cốc khuấy đều đến khi phẩn ứng xảy ra hoàn toàn thấy trong cốc có 0,14 mol kết tủa. Tính x?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phản ứng đầu không có kết tủa bị hòa tan, phản ứng sau có kết tủa bị hòa tan (nếu cả 2 phản ứng đều có kết tủa bị hòa tan thì số mol NaOH chênh lệch giữa 2 lần phải bằng số mol kết tủa chênh lệch của 2 lần)
Lần 2:
n A l ( O H ) 3 = 0 , 06 ⇒ n A l ( O H ) = 0 , 34 - 0 , 06 . 3 4 = 0 , 04 ⇒ n A l C l 3 = 0 , 06 + 0 , 04 = 0 , 1 ⇒ x = 1
Đáp án B

Nhận thấy khi thêm dung dịch NaOH thì khối lượng kết tủa giảm đi → xảy ra sự hòa tan kết tủa
→ 4×nAlCl3 = nNaOH + nkết tủa = 0,34 + 0,06 = 0,4 mol → nAlCl3 = 0,1 mol
→ x = 1 M.
Đáp án A

Do khối lượng kết tủa và số mol NaOH không tỉ lệ nên ở phần 2 đã có 1 phần kết tủa tan lại
Lần 2:
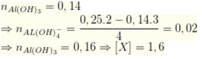

Ta thấy tỉ lệ số mol NaOH và số mol kết tủa không bằng nhau
Như vậy, phản ứng đầu chưa có kết tủa bị tan, ở phản ứng sau có kết tủa bị hòa tan
Phản ứng sau:
⇒
n
A
l
(
O
H
)
4
-
=
0
,
25
.
2
-
0
,
14
.
3
4
=
0
,
02
⇒
n
A
l
C
l
3
=
0
,
02
+
0
,
14
=
0
,
16
⇒
x
=
1
,
6
Đáp án A

Đáp án C.
TN1: 150 ml dd Y (NaOH 2M) vào 100 ml dd X (AlCl3) à 7,8 gam kết tủa Al(OH)3
TN2: Thêm tiếp vào cốc trên 100 ml dd Y à 10,92 gam kết tủa Al(OH)3
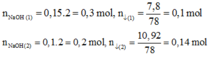



Đáp án B
Bản chất phản ứng là : Cho 340 ml dung dịch NaOH 1M vào cốc thủy tinh đựng 100 ml dung dịch AlCl 3 nồng độ x mol/lít, tạo ra 0,06 mol kết tủa. Ta có :
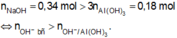
Suy ra đã có hiện tượng hòa tan kết tủa. Như vậy dung dịch sau phản ứng có chứa các ion Na + , Cl - và Al OH 4 - . Theo bảo toàn nguyên tố Cl, Al và bảo toàn điện tích, ta có :
![]()
![]()