Hòa tan hoàn toàn 3,9 gam một kim loại hóa trị I vào nước được một dung dịch bazơ X và 1,12 lít H2 (đktc). Tên kim loại hóa trị I là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D.
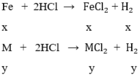
gọi x, y lần lượt là số mol của Fe và M trong hỗn hợp
số mol H2 là 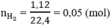
theo bài ra ta có hệ phương trình
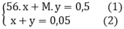
từ (2) → x= 0,05 – y
thay vào (1) ta được 56(0,05 – y) + My = 0,5
⇔ 2,8 – 56y + My = 0,5
2,3 = 56y – My
→ y = 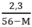
Ta có 0 < y < 0,05
y > 0 ↔ 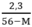 > 0 → 56 – M > 0 ⇒ M < 56
> 0 → 56 – M > 0 ⇒ M < 56
y < 0,05 ↔ 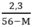 < 0,05 → 2,3 < 0,05(56 – M) → M < 10
< 0,05 → 2,3 < 0,05(56 – M) → M < 10
Trong các kim loại hóa trị II chỉ có Be thỏa mãn do đó M là Be

a) \(n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
=> nHCl = 0,27 (mol)
Theo ĐLBTKL: mkim loại + mHCl = mmuối + mH2
=> mmuối = 5,85 + 0,27.36,5 - 0,135.2 = 15,435 (g)
b) VH2 = 3,024 (l) (Theo đề bài)
c)
Hỗn hợp kim loại gồm \(\left\{{}\begin{matrix}Al:a\left(mol\right)\\X:3a\left(mol\right)\end{matrix}\right.\)
=> 27a + MX.3a = 5,85
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a----------------------->1,5a
X + 2HCl --> XCl2 + H2
3a------------------->3a
=> 1,5a + 3a = 0,135
=> a = 0,03 (mol)
=> MX = 56 (g/mol)
=> X là Fe

\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(2A+2nH_2O\rightarrow2A\left(OH\right)_n+nH_2\)
\(\dfrac{0.1}{n}........................0.05\)
\(M_A=\dfrac{3.9}{\dfrac{0.1}{n}}=39n\)
Với : \(n=1\rightarrow A=39\)
\(A:K\)
\(m_{KOH}=0.1\cdot56=5.6\left(g\right)\)
\(m_{ddX}=3.9+46.2-0.05\cdot2=50\left(g\right)\)
\(C\%_{KOH}=\dfrac{5.6}{50}\cdot100\%=11.2\%\)
\(b.\)
\(K_2O+H_2O\rightarrow2KOH\)
\(0.1....................0.2\)
\(m_{KOH}=0.2\cdot56=11.2\left(g\right)\)
\(m_{dd_X}=\dfrac{11.2}{28\%\%}=40\left(g\right)\)

Đáp án : D
Dung dịch X chỉ chứa 1 chất tan duy nhất
=> kim loại hóa trị 2 tan trong kiềm
Gọi kim loại kiềm là X và kim loại hóa trị 2 là Y
=> X + H2O -> XOH + ½ H2
2XOH + YO -> X2YO2 + H2O
=> 2nH2 = nX = nXOH = 0,4 mol
=> nX2YO2 = ½ nX = 0,2 mol
=> CM = 0,4M

Số mol của khí hidro ở dktc
nH2 =\(\dfrac{V_{H2}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : X + 2HCl → XCl2 + H2\(|\)
1 2 1 1
0,1 0,1
Số mol của kim loại X
nX = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ MX = \(\dfrac{m_X}{n_X}=\dfrac{5,6}{0,1}=56\) (dvc)
Vậy kim loại x là Fe
⇒ Chọn câu : B Chúc bạn học tốt
\(R+2HCl \rightarrow RCl_2+H_2\\ n_{H_2}=\frac{2,24}{22,4}=0,1mol\\ M_R=\frac{5,6}{0,1}=56 g/mol\\ \Rightarrow R: Fe\)

nH2 = 3.36/22.4 = 0.15 (mol)
M + H2SO4 => MSO4 + H2
0.15________________0.15
MM = 3.6/0.15 = 24
M là : Mg
PT: \(M+H_2SO_4\rightarrow MSO_4+H_2\)
Ta có: \(n_{H_2}=0,15\left(mol\right)\)
Theo PT: \(n_M=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{3,6}{0,15}=24\left(g/mol\right)\)
Vậy: M là Mg.
Bạn tham khảo nhé!



\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(A+H_2O\rightarrow AOH+\dfrac{1}{2}H_2\)
\(0.1................................0.05\)
\(M_A=\dfrac{3.9}{0.1}=39\left(đvc\right)\)
\(A:K\left(kali\right)\)
cho mình hỏi 1/2 h2 là như nào vậy ạ. Mình cảm ơn