1.Hai lá kẽm có m như nhau.Cho lá kẽm thứ nhất vào dd đồng II nitrat.Cho lá kẽm thứ hai vào dd chì II nitrat.Sau cùng 1 thời gian pứ thấy khối lượng lá kẽm thư nhất giảm 0,05g.Khối lượng lá kẽm thứ hai tăng hay giảm?Biết rằng trong 2 pứ trên,khối lượng kẽm bị hòa tan bằng nhau
2.Cho 3,92g bột sắt vào 200ml dd CuSO4 15% có m riêng là 1,12g/ml.Tính m kim loại tạo thành sau pứ và nồng độ mol của các chất trong dd sau pứ(thể tích dd sau pứ thay đổi k đáng kể) (Azue)

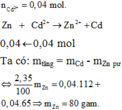
2.Áp dụng công thức: m=DxV
=>mdd CuSO4=100x1,12=112gam
=>mCuSO4=112x10%=11,2gam
=>nCuSO4=11,2/160=0,07mol
nFe=3,2/56=0,057mol
Lập tỉ lệ theo phương trình: =>Fe hết , CuSO4 dư
Lập các số mol trên phương trình
=>Dung dịch thu được chứa FeCO4 và CuSO4
=>Cm(FeCO4)=0,057/0,1=0,57M
=>Cm(FeCO4)=(0,07-0,057):0,1=0,13M
Bai1 :
Vif Hai lá kẽm có m như nhau <=> mZn(1) = mZn(2)
khối lượng 2 lá kẽm bị hòa tan bằng nhau.
maf kẽm thư nhất giảm 0,05g => mZn(2) giảm 0,05 (g)
Bai 2 :
Theo de bai ta co :
mddCuSO4 = 1,12.200 = 224(g)
=> nCuSO4 = \(\dfrac{224.15}{100.160}=0,21\left(mol\right)\)
nFe = \(\dfrac{3,92}{56}=0,07\left(mol\right)\)
PTHH :
\(Fe+CuSO4->FeSO4+Cu\)
0,07mol...0,07mol......0,07mol
Theo PTHH ta co : \(nFe=\dfrac{0,07}{1}mol< nCuSO4=\dfrac{0,21}{1}mol=>nCuSO4\left(du\right)\) ( tinh theo nFe)
=> \(\left\{{}\begin{matrix}CM_{FeSO4}=\dfrac{0,07}{0,2}=0,35\left(M\right)\\CM_{CuSO4\left(du\right)}=\dfrac{0,21-0,07}{0,2}=0,7\left(M\right)\end{matrix}\right.\)