Hoà tan hoàn toàn 1,68g kim loại M có hoá trị II bằng 100ml dung dịch H2SO4 0,4 M. Để trung hoà lượng axit dư người ta đã dùng 40ml dung dịch NaOH 0,5M. Hỏi kim loại đó là kim loại nào?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{NaOH}=0.06\cdot0.5=0.03\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\dfrac{0.03}{2}=0.015\left(mol\right)\)
\(n_{H_2SO_4\left(pư\right)}=0.25\cdot0.3-0.015=0.06\left(mol\right)\)
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(0.06....0.06\)
\(M_R=\dfrac{1.44}{0.06}=24\left(\dfrac{g}{mol}\right)\)
\(R:Mg\)

Gọi kim loại là M
M + H2SO4 ---> MSO4 + H2 (1)
H2SO4 + 2NaOH ---> Na2SO4 + 2H2O (2)
Số mol H2SO4 ban đầu = 0,5.0,15 = 0,075 mol; số mol H2SO4 dư = 1/2 số mol NaOH = 0,5.1.0,03 = 0,015 mol. Số mol H2SO4 phản ứng (1) = 0,075 - 0,015 = 0,06.
số mol muối MSO4 = số mol H2SO4 p.ư (1) nên: M + 96 = 7,2/0,06 = 120. Vậy: M = 24 (Mg).

Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
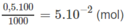
Số mol NaOH trong 33,4 ml nồng độ 1M :
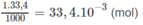
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 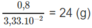
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.

Gọi kim loại cần tìm là R
\(n_{H_2SO_4}=0,25.0,3=0,075\left(mol\right)\)
\(n_{KOH}=0,06.0,5=0,03\left(mol\right)\)
PTHH: R + H2SO4 --> RSO4 + H2
0,06<--0,06
2KOH + H2SO4 --> K2SO4 + 2H2O
0,03-->0,015
=> \(M_R=\dfrac{1,44}{0,06}=24\left(g/mol\right)\)
=> R là Mg
Số mol H2SO4 và KOH lần lượt là 0,3.0,25=0,075 (mol) và 0,5.0,06=0,03 (mol).
Số mol H2SO4 phản ứng là (0,075.2-0,03):2=0,06 (mol) và bằng số mol của kim loại ban đầu.
Nguyên tử khối của kim loại cần tìm là 1,44:0,06=24 (g/mol).
Vậy kim loại đã cho là magie (Mg).

\(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: \(R+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow RSO_4+SO_2\uparrow+2H_2O\)
0,2<-------------------------------------0,2
\(\rightarrow M_R=\dfrac{12,8}{0,2}=64\left(\dfrac{g}{mol}\right)\\ \rightarrow R:Cu\)
Khí thoát ra là SO2
\(R\rightarrow R^{2+}+2e\\ S^{+6}+2e\rightarrow S^{+4}\\ n_{SO_2}=\dfrac{4,48}{22,4}=0,2\\ Bảotoàne:n_R.2=n_{S^{+4}}.2\\ \Rightarrow n_R=0,2\left(mol\right)\\ \Rightarrow M_R=\dfrac{12,8}{0,2}=64\left(Cu\right)\)

Đáp án A
M + H2SO4 → MSO4 + H2 (1)
2KOH + H2SO4 → K2SO4 + 2H2O (2)
![]()
Mà
![]()
![]()
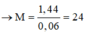
M là Magie



Theo giả thiết ta có : nH2SO4 = 0,4.0,1 = 0,04 (mol) ; \(n_{NaOH}=0,04.0,5=0,02\left(mol\right)\)
Ta có PTHH :
\(\left(1\right)M+H_2SO4->MSO_4+H_2\uparrow\)
\(\left(2\right)2NaOH+H_2SO_4->Na_2SO_4+2H_2O\)
0,02mol...........0,01mol
Vì nH2SO4 dư 0,01 mol nên => nH2SO4 phản ứng với kim loại M ở PTHH 1 là 0,03 mol
Theo PTHH (1) ta có : nM = nH2SO4 = 0,03 (mol)
=> \(M_M=\dfrac{mM}{nM}=\dfrac{1,68}{0,03}=56\left(\dfrac{g}{mol}\right)\left(nh\text{ận}\right)\left(Fe=56\right)\)
Vậy kim loại M có hóa trị II cần tìm là sắt ( Fe)