Đốt cháy hoàn toàn 0,74 gam chất rắn A cần dùng 1,12 dm3 không khí (đktc) chứa 20% VO2. Sản phẩm là CO2, H2O và Na2CO3 trong đó có 244 cm3 CO2 (đktc) và 0,53 gam Na2CO3. Tìm công thức hiđrocacbon
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1,12 dm3= 1,12 lit
224cm3 = 0.224lit
n(kk)= 1,12/ 22,4 =0,05 mol
n (O2)= 0,05x 20%= 0,01 mol
n(CO2)= 0,01 mol
n(Na2CO3) = 0,005 mol
suy ra
m( sản phẩm)= m ( chất phản ứng) = 0,74 + 0,01x 32=1,06 g
m(H2O)= 1,06 – 0,01x 44 – 0,53= 0,09g
n(H2O)=0,005 mol
vì đốt A tạo ra CO2 Na2CO3 và H2O nên trong A có Na, C, H và có thể có O
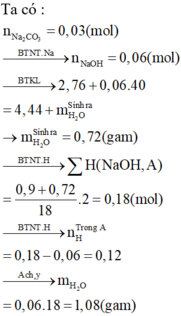
Ta có:
nO ( có trong sản phẩm) = 0,01x2 + 0,005x3 +0,005= 0,04 mol > nO (O2)= 0,01x2=0,02 mol
trong A có O
nO (A) = 0,04- 0,02 = 0,02 mol
n Na(A) = 0,005x2= 0,01 mol
nH(A)=0,005x2= 0,01 mol
nC (A)= 0,01 + 0,005= 0,015mol
nNa : nH : nC : nO= 0,01: 0,01: 0,015 : 0,02

CÂU 2) Nguyên tố hh là :
a. yếu tố cơ bản cấu tạo nên nguyên tử
b. phần tử cơ bản tạo nên vật chất
c. ngyên tử cùng loại
d. phần tử chính cấu tạo nên nguyên tử
Câu 1 :
\(V_{kk}=1.12\left(l\right)\)
\(\Rightarrow n_{O_2}=\dfrac{1.12}{22.4}\cdot20\%=0.01\left(mol\right)\)
\(n_{CO_2}=\dfrac{0.224}{22.4}=0.01\left(mol\right)\)
\(n_{Na_2CO_3}=\dfrac{0.53}{106}=0.005\left(mol\right)\)
\(BTKL:\)
\(m_{H_2O}=0.74+0.01\cdot32-0.01\cdot44-0.53=0.09\left(g\right)\)
\(n_{H_2O}=\dfrac{0.09}{18}=0.005\left(mol\right)\)
\(m_{O\left(X\right)}=0.74-0.015\cdot12-0.005\cdot2-0.005\cdot2\cdot23=0.32\left(g\right)\)
\(n_O=0.02\left(mol\right)\)
\(CT:C_xH_yO_zNa_t\)
\(x:y:z:t=0.015:0.01:0.02:0.01=3:2:4:2\)
\(CT:C_3H_2O_4Na_2\)

a, Theo giả thiết ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(4P+5O_2--t^o->2P_2O_5\)
Ta có: \(n_{O_2}=\dfrac{5}{4}.n_P=0,125\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)
b, Theo giả thiết ta có: \(n_{CH_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=0,1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=2,24\left(l\right)\)

Đáp án C
Ta có mBình tăng = mCO2 + mH2O = 13,3 gam.
Với nCO2 = nBaCO3 = 0,2 mol ||⇒ nH2O = 0,25 mol.
Nhận thấy nC ÷ nH = 0,2 ÷ (0,25×2) = 2 ÷ 5

Đáp án A
,nO2 = 0,1875 mol
Bảo toàn khối lượng : mA + mO2 = mCO2 + mN2 + mH2O
=> mCO2 + mN2 = 7,3g
Mặt khác : nCO2 + nN2 = 0,175 mol
=> nCO2 = 0,15 ; nN2 = 0,025 mol
Bảo toàn O : nO(A) = 2nCO2 + nH2O – 2nO2 = 0,1 mol
=> nC : nH : nO : nN = 0,15 : 0,0,35 : 0,1 : 0,05 = 3 : 7 : 2 : 1
Vì A chỉ có 1 nguyên tử N nên A có CTPT là : C3H7O2N

Bn check lại đề chứ mình nghĩ VCO2 = 0,672
\(n_{CO_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
\(n_{H_2O}=\dfrac{0,54}{18}=0,03\left(mol\right)\)
Bảo toàn C: nC(Y) = 0,03 (mol)
Bảo toàn H: nH(Y) = 2.0,03 = 0,06 (mol)
=> \(n_O=\dfrac{0,74-0,03.12-0,06}{16}=0,02\left(mol\right)\)
nC : nH : nO = 0,03 : 0,06 : 0,02 = 3:6:2
=> CTHH: (C3H6O2)n
Mà M = 2.37 = 74
=> n = 1
=> CTHH: C3H6O2

Bảo toàn nguyên tố N có: n C 2 H 5 N H 2 = 2 n N 2 = 0 , 1 m o l
m C 2 H 5 N H 2 = 0 , 1.45 = 4 , 5 g a m
Đáp án cần chọn là: C
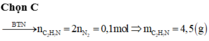
$n_{O_2} = \dfrac{1,12}{22,4}.20\% = 0,01(mol)$
$n_{CO_2} = \dfrac{244}{1000.22,4} = 0,01(mol)$
$n_{Na_2CO_3} = 0,005(mol)$
Bảo toàn khối lượng : $n_{H_2O} = \dfrac{0,74 + 0,01.32 - 0,01.44 - 0,53}{18} = 0,005(mol)$
Ta có :
$n_C = n_{CO_2} + n_{Na_2CO_3} = 0,015(mol)$
$n_H = 2n_{H_2O} = 0,01(mol)$
$n_O = 0,01.2 + 0,005.3 + 0,005 - 0,01.2 = 0,02(mol)$
$n_{Na} = 2n_{Na_2CO_3} = 0,005.2 = 0,01(mol)$
Ta có:
$n_C : n_H : n_O : n_{Na} = 0,015 : 0,01 : 0,02 : 0,01 = 3 : 2 : 4 : 2$
Vậy A có CTĐGN là $C_3H_2O_4Na_2$
Mình thấy ko hiểu đề cho lắm