trộn 2 thể tích dd HCl 0,1M với 1 thể tích dd gồm NaOH 0,2M và Ba(OH)2 0,15 mol thu được dd Z có ph = ??
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Để có được 300ml dung dịch A thi phải cần mỗi dung dịch axit là 100ml
=> tổng n H+= ( 0,1.2 + 0,2 + 0,3 ). 0,1 = 0,07 mol
Ở dung dịch B có tổng n OH− = 0,49.V mol
rõ ràng dung dịch thu được pH = 2 => dư H^+ = 0,01. ( 0,3 + v ) mol (1)
phản ứng : H+ +OH− → H2O
theo phản ứng thì nH+ dư = 0,07 - 0,49.V (2) từ 1 và 2 => 0,07 - 0,49.V = 0,01. ( 0,3 + v )
=> V = 0,134 lit
=> Đáp án D

\(n_{H^+}=0.3\cdot0.1\cdot2+0.3\cdot0.15=0.105\left(mol\right)\)
\(n_{OH^-}=0.001V\cdot0.3+0.001V\cdot2\cdot0.1=0.0032V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.105.......0.105\)
\(n_{OH^-\left(dư\right)}=0.0032V-0.105\left(mol\right)\)
\(\left[OH^-\right]=\dfrac{0.0032V-0.105}{0.3+0.001V}\left(M\right)\)
\(pH=14+log\left[OH^-\right]=12\)
\(\Leftrightarrow log\left[OH^-\right]=-2\)
\(\Leftrightarrow log\left[\dfrac{0.0032V-0.105}{0.3+0.001V}\right]=-2\)
\(\Leftrightarrow V=33.85\left(ml\right)\)
nH+=0,3.0,1.2+0,3.0,15=0,105 mol
nOH- ban đầu =0,3V + 0,1.2V=0,5V mol
Sau phản ứng thu được dung dịch có pH=12
⇒OH- dư ⇒ pOH=2
⇒ [OH- ] dư = 0,01 M
nOH- dư = 0,01(0,3+V)=0,003+0,01V (mol)
nOH- phản ứng=nOH- ban đầu - nOH- dư
= 0,5V - 0,003 - 0,01V
= 0,49V - 0,003 (mol )
H+ + OH- → H2O
0,105 → 0,105
nOH- phản ứng = nH+
⇒0,49V - 0,003 =0,105
⇒ V≃0,22 lít=200ml

Câu 15 :
$n_{HCl} = 0,2.0,1 = 0,02(mol)$
$n_{H_2SO_4} = 0,2.0,05 = 0,01(mol)$
$\Rightarrow n_{H^+} = 0,02 + 0,01.2 = 0,04(mol)$
$n_{OH^-\ dư} = 0,5.(10-14 : 10-13) = 0,05(mol)$
$H^+ + OH^- \to H_2O$
$n_{OH^-} = 0,04 + 0,05 = 0,09(mol)$
$n_{Ba(OH)_2} = \dfrac{1}{2}n_{OH^-} = 0,045(mol)$
$a = 0,045 : 0,3 = 0,15(M)$
$Ba^{2+} + SO_4^{2-} \to BaSO_4$
$n_{Ba^{2+}} = 0,045 > n_{SO_4^{2-}} = 0,01$ nên $Ba^{2+}$ dư
n BaSO4 = n SO4 = 0,01(mol)
=> m = 0,01.233 = 2,33(gam)
Đáp án A

+nHCl=0.2*0.4=0.08(mol)
=>nH{+}=0.08(mol)
+nHNO3=0.1*0.4=0.04(mol)
=>nH{+}=0.04(mol)
+nH2SO4=0.15*0.4=0.06(mol)=nSO4{2-}
=>nH{+}=0.06*2=0.12(mol)
=>nH{+}(tổng)=0.08+0.04+0.12=0.24(mol)
+nNaOH=0.2*10^-3V(mol)
=>nOH{-}=2*10^-4V(mol)
+nBa(OH)2=0.05*10^-3V(mol)=nBa{2+}
=>nOH{-}=2*5*10^-5V=10^-4V(mol)
=>nOH{-}(tổng)=2*10^-4V+10^-4V=3*10^-4...
_Sau phản ứng thu được dung dịch có pH=13=>môi trường có tính bazơ.
=>pOH=14-13=1=>[OH-] dư=10^-1(M)
=>nOH{-} dư=10^-1*(0.4+10^-3V)(mol)
H{+}+OH{-}=>H2O
0.24->3*10^-4V...(mol)
0.24->0.24...........(mol)
0------>3*10^-4V-0.24.(mol)
=>3*10^-4V-0.24=0.04+10^-4V
<=>2*10^-4V=0.28
<=>V=1400(ml)
Vậy cần V=1400 ml
_Sau phản ứng kết tủa tạo thành là BaSO4:
+nBa{2+}=5*10^-5*(1400)=0.07(mol)
+nSO4{2-}=0.06(mol)
Ba{2+}+SO4{2-}=>BaSO4
0.07>0.06----------->0.06(mol)
=>mBaSO4=0.06*233=13.98(g)

B4:
nNaOH = 0,3 . 1,5 + 0,4 . 2,5 = 1,45 (mol)
VddNaOH = 0,3 + 0,4 = 0,7 (l)
CMddNaOH = 1,45/0,7 = 2,07M
B5:
nHCl (sau khi pha) = 0,5 . 2 = 1 (mol)
Gọi VHCl (0,2) = x (l); VHCl (0,8) = y (l)
x + y = 2 (1)
nHCl (0,2) = 0,2x (mol)
nHCl (0,8) = 0,8y (mol)
=> 0,2x + 0,8y = 1 (2)
(1)(2) => x = y = 1 (l)

Theo gt ta có: $n_{H_2SO_4}=0,2(mol);n_{HCl}=0,15(mol);n_{H_2}=0,25(mol)$
a, Bảo toàn H ta có: $n_{H^+/pu}=0,5(mol)< 0,55(mol)$
Do đó axit còn dư
b, Ta có: $n_{Ba(OH)_2}=0,18(mol);n_{NaOH}=0,3(mol)$
Gọi số mol Mg và Al lần lượt là a;b(mol)
$\Rightarrow 24a+27b=5,1$
Bảo toàn e ta có: $2a+3b=0,5$
Giải hệ ta được $a=b=0,1$
Lượng $OH^-$ tạo kết tủa là $0,18.2+0,3-0,05=0,61(mol)$
Kết tủa gồm 0,18 mol $BaSO_4$; 0,1 mol $Mg(OH)_2$ (Do Al(OH)3 tạo ra bị hòa tan hết)
$\Rightarrow m_{kt}=47,74(g)$

a, \(\left\{{}\begin{matrix}n_{Ba^{2+}}=4.10^{-3}\left(mol\right)\\n_{Na^+}=3.10^{-3}\left(mol\right)\\n_{OH^-}=0,011\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\left[Ba^{2+}\right]=\dfrac{4.10^{-3}}{0,2+0,3}=0,008M\\\left[Na^+\right]=\dfrac{3.10^{-3}}{0,2+0,3}=0,006M\\\left[OH^-\right]=\dfrac{0,011}{0,2+0,3}=0,022M\end{matrix}\right.\)
b, Để trung hòa dung dịch A thì:
\(n_{H^+}=n_{OH^-}\)
\(\Leftrightarrow0,01.V_{ddHCl}=\left(0,02.2+0,01\right).0,2\)
\(\Leftrightarrow V_{ddHCl}=1\left(l\right)\)
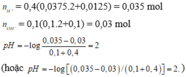

và Ba(OH)2 0,15 M chứ nhỉ?
Gỉa sử \(V=1\left(lit\right)\)
\(\Rightarrow n_{H^+}=0,2\left(mol\right)\)
\(n_{NaOH}=0,2\left(mol\right);n_{Ba\left(OH\right)_2}=0,15\left(mol\right)\)
\(\Rightarrow n_{OH^-}=0,5\left(mol\right)\)
\(H^+\left(0,2\right)+OH^-\left(0,2\right)\rightarrow H_2O\)
\(\Rightarrow n_{OH^-}\left(dư\right)=0,3\left(mol\right)\)
\(\Rightarrow pOH=-log\left(\dfrac{0,3}{3}\right)=1\)
\(\Rightarrow pH=14-pOH=14-1=13\)
Lê Văn Huy