1. Cho 5,6 gam sắt tác dụng với dung dịch có chứa 7,3 gam HCL. Tính khối lượng chất dư và thể tích khí H2 thoát ra (ở điều kiện tiêu chuẩn)
2. Cho 6 gam Al phản ứng với dung dịch H2SO4 thu được Al2(SO4)3 và 6,7 lít khí H2. Tính khối lượng Al đã phản ứng với khối lượng Al2(SO4)3 đã thu được.

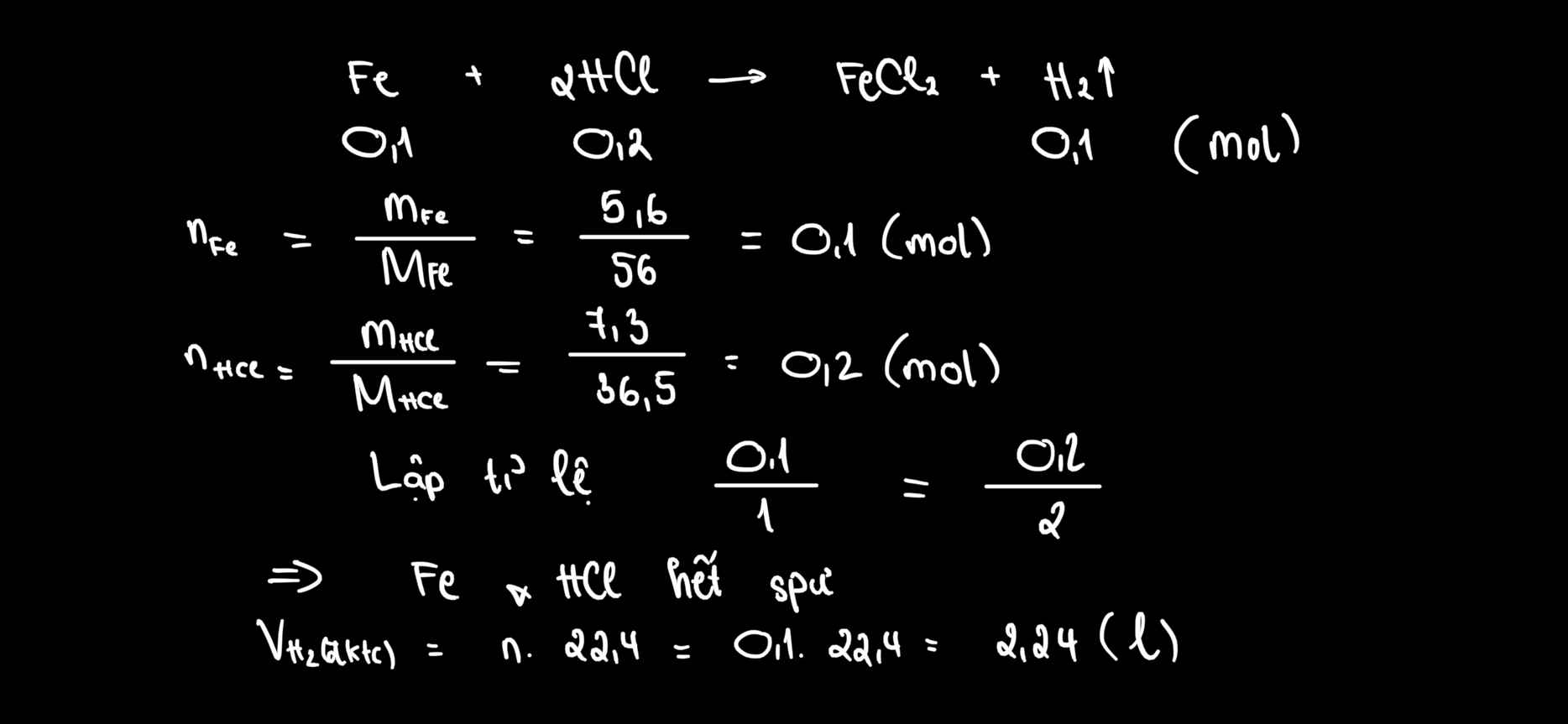

các bạn giải giùm mình bài này với
Thanks các bạn nhiều nha!
Bài 1:
Ta có nFe = \(\dfrac{5,6}{56}\) = 0,1 ( mol )
nHCl = \(\dfrac{7,3}{36,5}\) = 0,2 ( mol )
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
0,1.....0,2
=> Lập tỉ số \(\dfrac{0,1}{1}:\dfrac{0,2}{2}\) = 0,1 = 0,1
=> Không có chất nào dư cả nha bạn chắc bạn ghi đề sai rồi
=> VH2 = 0,1 . 22,4 = 2,24 ( lít )