Câu 1 :Cho m gam hỗn hợp Gồm 2 kim loại nhôm và kẽm phản ứng vừa đủ với dung dịch chứa 39,2 gam axit sunfuric H2SO4 .Sau PƯ thu đc hỗn hợp 2 muỗi và 8,96 lít khí hidro ở đktc
a, Tính giá trị m
b, Tính khối lượng hỗn hợp muối
Câu 2:Cho 16,9 kẽm vào hỗn hợp gồm HCl và H2SO4 ,sau PƯ kết thúc thì thu đc 4,48 lít khí hidro (đktc)
a, C/m kẽm dư
b, Tính tổng khối lượng muối ZnCl2 và ZnSO4 ,biết số mol 2 axit PƯ là như nhau
Giúp với cả nhà ơi cảm ơn nhiều nha ^^

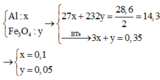
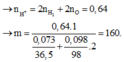
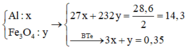
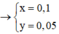
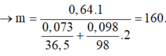

Câu 2 : Đề bài ko cho klg của hh nên làm đại thế này !
Theo đề bài ta có :
\(\left\{{}\begin{matrix}nZn=\dfrac{16,9}{65}=0,26\left(mol\right)\\nH2=\dfrac{4,48}{22,4}=0,2\left(mol\right)\end{matrix}\right.\)
a) Ta có PTHH :
(1) \(Zn+2HCl->ZnCl2+H2\uparrow\)
(2) \(Zn+H2SO4->ZnSO4+H2\uparrow\)
Theo 2PTHH ta có :
1 mol Zn thì tạo ra 1 mol khí H2
Mà nZn(ban đầu) = 0,26 (mol ) nH2(ban đầu) = 0,2 (mol)
Ta có :
\(nZn=\dfrac{0,26}{1}mol>nH2=\dfrac{0,2}{1}mol\)
=> nZn dư
b) Vì nHCl = nH2SO4 nên => nH2 ở 2PTHH là bằng nhau
Theo 2 PTHH ta có :
nZnCl2= nZnSO4 = nH2 = 0,2 (mol)
=> m(tổng 2 muối) = mZnCl2 + mZnSO4 = 0,2.135 + 0,2.160 = 59(g)
Vậy.............
2, goi x la so mol cua H2 pt (1)
y la so mol cua H2 pt (2)
\(n_{Zn}=\dfrac{16,9}{65}=0,26\left(mol\right)\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo pt ta thấy: nZn = nH2
nhưng theo đề thì nZn > nH2
a, => Zn dư
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2 (1)
de: 2x \(\leftarrow\) x \(\leftarrow\) x Zn + H2SO4 \(\rightarrow\) ZnSO4 + H2 (2)
de: y \(\leftarrow\) y \(\leftarrow\) y
b, Ta co: 2x = y ; x + y = 0,2
=> x = 1/15 ; y = 2/15
\(m_{ZnCl_2}=\dfrac{1}{15}.136\approx9,067g\)
\(m_{ZnSO_4}=\dfrac{2}{15}.161\approx21,467g\)