1. Hoà tan hoàn toàn m gam oxit FexOy bằng dung dịch H2SO4 đặc nóng vừa đủ, có chứa 0,1 mol H2SO4, thu được z gam muối Fe2(SO4)3 và thoát ra 224 ml khí SO2 (sản phẩm khử duy nhất, đo ởđktc). Tổng ( m +z) bằng
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

19 tháng 7 2017
Đáp án D.
nSO2 = 0,55 => ne = 0,55.2 = 1,1 (mol)
mmuối = mKL + Mgốc axit. ne/2
= 14,6 + 96. 1,1/2 = 67,4 g

H
15 tháng 8 2021
Coi oxit gồm $Fe(x\ mol) ; O(y\ mol)$
Ta có : 56x + 16y = 20,88(1)$
$n_{SO_2} = 0,145(mol)$
Bảo toàn electron : $3x = 2y + 0,145.2(2)$
Từ (1)(2) suy ra x = 0,29 ; y = 0,29$
$n_{Fe} : n_O = 0,29 : 0,29 = 1 : 1$
Do đó, oxit là $FeO$
$n_{Fe_2(SO_4)_3} = \dfrac{1}{2}n_{Fe} = 0,145(mol)$
$m_{Fe_2(SO_4)_3} = 0,145.400 = 58(gam)$


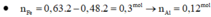
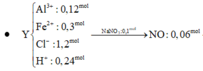
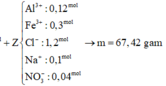
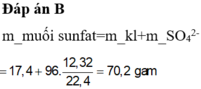
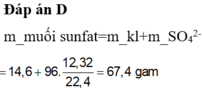


$n_{SO_2} = 0,01(mol)$
Bảo toàn nguyên tố với S :
$n_{H_2SO_4} = 3n_{Fe_2(SO_4)_3} + n_{SO_2}$
$\Rightarrow n_{Fe_2(SO_4)_3} = \dfrac{0,1 - 0,01}{3} = 0,03(mol)$
$z = 0,03.400 = 12(gam)$
$n_{Fe} = 2n_{Fe_2(SO_4)_3} = 0,06(mol)$
Bảo toàn e : $3n_{Fe} = 2n_O + 2n_{SO_2} \Rightarrow n_O = \dfrac{0,06.3 - 0,01.2}{2} = 0,08(mol)$
$n_{Fe} : n_O = 0,06 : 0,08 = 3 : 4$
Vậy oxit là $Fe_3O_4$
$m + z = \dfrac{0,06}{3}.232 + 12 = 16,64$