Muối clorua của một kim loại có hóa trị I có 14,8% clo về khối lượng. Xác định công thức của muối?
Cảm ơn nhiều nhé!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi KL cần tìm là M
\(n_{AgNO_3}=\dfrac{170}{170}=1(mol)\\ MCl_2+2AgNO_3\to M(NO_3)_2+2AgCl\downarrow\\ \Rightarrow n_{MCl_2}=\dfrac{1}{2}n_{AgNO_3}=0,5(mol)\\ \Rightarrow M_{MCl_2}=\dfrac{55,5}{0,5}=111(g/mol)\\ \Rightarrow M_M=111-35,5.2=40(g/mol)(Ca)\\ n_{Ca(NO_3)_2}=0,5(mol);n_{AgCl}=1(mol)\\ \Rightarrow m_{Ca(NO_3)_2}=0,5.164=82(g);m_{AgCl}=1.143,5=143,5(g)\)

Gọi kim loại cần tìm là M, có hóa trị là n
Công thức muối clorua là MCln
Công thức muối nitrat là M(NO3)n. Có số mol là x
Theo bài ra ta có hệ phương trình :
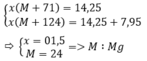

Giả sử n < m
- Với RCln: \(\%Cl=\dfrac{35,5n}{M_R+35,5n}.100\%=55,91\%\)
=> MR = 28n (g/mol)
- Với RClm: \(\%Cl=\dfrac{35,5m}{M_R+35,5m}.100\%=65,539\%\)
=> MR = 18,66m (g/mol)
TH1: n = 1 => MR = 28 => Loại
TH2: n = 2 => MR = 56 (g/mol) => R là Fe => m = 3 (thỏa mãn)
Thế gọi n là hoá trị thấp, m là hoá trị cao. (m,n:nguyên, dương)
\(\Rightarrow\left\{{}\begin{matrix}\dfrac{35,5n}{M_R+35,5n}.100\%=55,91\%\\\dfrac{35,5m}{M_R+35,5m}.100\%=65,539\%\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}\dfrac{M_R}{35,5n}=\dfrac{44,09\%}{55,91\%}=0,789\\\dfrac{M_R}{35,5m}=\dfrac{34,461\%}{65,539\%}=0,526\end{matrix}\right.\)
Xét các giá trị từ 1 đến 3 (m>n) ta nhận giá trị n=2 và m=3 => MR=56(g/mol)
=> R là Sắt (Fe=56)