Cho 19.1g hỗn hợp kim loại Al và Ba vào dung dịch H2SO4 dư. Sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp muối và 8.96l khí H2 thu được ở đktc
a. Tính % KL mỗi kim loại có trong hỗn hợp
b. Tính KL H2SO4 cần dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có:
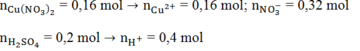
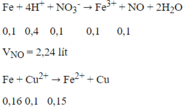
Do Fe nên tiếp tục xảy ra phản ứng:

nFe phản ứng = 0,1 + 0,05 + 0,16 = 0,31 mol
0,6m (g) hỗn hợp bột kim loại sau phản ứng gồm Fe dư và Cu sinh ra:
m - mFe pư + mCu = 0,6m → m - 0,31.56+ 64.0,16 = 0,6m
m = 17,8 (g)

\(n_{Cu\left(NO_3\right)_2}=0,5.0,2=0,1\left(mol\right)\)
\(n_{NO_3^-}=0,1.2=0,2\left(mol\right)\)
\(n_{Cu^{2+}}=0,1\left(mol\right)\)
\(n_{HCl}=n_{H^+}=0,5.1,8=0,9\left(mol\right)\)
\(n_{NO}=\dfrac{n_{H^+}}{4}=\dfrac{0,9}{4}=0,225\left(mol\right)\)
Sau phản ứng thu được hỗn hợp kim loại \(\Rightarrow\) Cu và Fe \(\Rightarrow\) \(Fe^{2+}\)
Bảo toàn e:
\(2n_{Fe.pứ}=3n_{NO}+2n_{Cu^{2+}}\)
\(\Rightarrow n_{Fe.pứ}=0,4375\left(mol\right)\)
Có: \(a-m_{Fe.pứ}+m_{Cu}=m_{hh.kl}=0,5\)
\(\Leftrightarrow a-0,4375.56+64.0,1=0,5\\ \Rightarrow a=18,6\)

a, Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
a--->2a------------------>a
2Al + 6HCl ---> 2AlCl3 + 3H2
b---->3b-------------------->1,5b
=> \(\left\{{}\begin{matrix}56a+27b=16,6\\a+1,5b=0,5\end{matrix}\right.\Leftrightarrow a=b=0,2\left(mol\right)\)
=> \(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
b) \(C\%_{HCl}=\dfrac{\left(0,2.2+0,2.3\right).36,5}{300}.100\%=12,167\%\)
\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
gọi nFe : a , nAl: b (a,b>0) => 56a + 27b = 16,6 (g)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a a
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
b \(\dfrac{3b}{2}\)
=> \(a+\dfrac{3b}{2}=0,5\)
ta có hệ pt
\(\left\{{}\begin{matrix}56a+27b=16,6\\a+\dfrac{3b}{2}=0,5\end{matrix}\right.\)
=> a= 0,2 , b = 0,2
\(\left\{{}\begin{matrix}m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=16,6-11,2=5,4\left(g\right)\end{matrix}\right.\)
\(pthh:Fe+2HCl\rightarrow FeCl_2+H_2\)
0,2 0,4
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,6
=> \(m_{HCl}=\left(0,4+0,6\right).36,5=36,5\left(g\right)\)
=> \(C\%=\dfrac{36,5}{200}.100\%=18,25\%\)

Ta có:
\(n_{CO_2}=\frac{1.12}{22.4}=0.05\left(mol\right)\) \(\Rightarrow m_{CO_2}=0.05\times44=2.2\left(g\right)\)
\(X_2CO_3+2HCl\rightarrow2XCl+H_2O+CO_2\)
\(YCO_3+2HCl\rightarrow YCl_2+H_2O+CO_2\)
Ta thấy
\(n_{HCl}=2n_{CO_2}=2\times0.05=0.1\left(mol\right)\)
\(\Rightarrow\) \(m_{HCl}=0.1\times36.5=3.65\left(g\right)\)
\(n_{H_2O}=n_{CO_2}=0.05\left(mol\right)\)
\(\Rightarrow\) \(m_{H_2O}=0.05\times18=0.9\left(g\right)\)
Áp dụng định luật bảo toàn khối lượng ta được:
\(m_{XCl+YCl_2}=\left(5.95+3.65\right)-\left(2.2+0.9\right)=9.6-3.1=6.5\left(g\right)\)
PTTH: 2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2\(\uparrow\) (1)
Theo pt: 2 ......... 3 ................. 1 ............. 3 ......... (mol)
Theo đề: 0,2 .... 0,3 .............. 0,1 ........... 0,3 ...... (mol)
PTHH: Ba + H2SO4 \(\rightarrow\) BaSO4\(\downarrow\) + H2\(\uparrow\) (2)
Theo pt: 1 ........ 1 ............. 1 ........... 1 ...... (mol)
Theo đề: 0,1 ... 0,1 .......... 0,1 ........ 0,1 ..... (mol)
a) \(n_{H_2}=\dfrac{V_{đktc}}{22,4}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Gọi x (mol) là số mol của H2(1) \(\Rightarrow\) nH2(2) = 0,4 - x (mol)
Do đó: \(n_{Al}=\dfrac{2x}{3}\left(mol\right)\) và \(n_{Ba}=0,4-x\left(mol\right)\)
Ta có: \(m_{Al}+m_{Ba}=19,1\left(gt\right)\) \(\Leftrightarrow27.\dfrac{2x}{3}+137\left(0,4-x\right)=19,1\)
\(\Leftrightarrow18x+54,8-137x=19,1\)
\(\Leftrightarrow18x-137x=19,1-54,8\)
\(\Leftrightarrow-119x=-35,7\)
\(\Leftrightarrow x=0,3\left(mol\right)\)
Suy ra: \(n_{Al}=\dfrac{2x}{3}=\dfrac{2.0,3}{3}=0,2\left(mol\right)\)
và \(n_{Ba}=0,4-x=0,4-0,3=0,1\left(mol\right)\)
\(m_{Al}=n.M=0,2.27=5,4\left(g\right)\)
\(m_{Ba}=n.M=0,1.137=13,7\left(g\right)\)
\(\%m_{Al}=\dfrac{m_{Al}}{m_{hh}}.100\%=\dfrac{5,4}{19,1}.100\%\approx28,27\%\)
\(\%m_{Ba}=\dfrac{m_{Ba}}{m_{hh}}.100\%=\dfrac{13,7}{19,1}.100\%\approx71,73\%\)
b) \(m_{H_2SO_4}=m_{H_2SO_{4\left(1\right)}}+m_{H_2SO_{4\left(2\right)}}=98\left(0,3+0,1\right)=39,2\left(g\right)\)