khử hoàn toàn 2,552 gam một oxit kim lại cần 985,6 ml H2 (đktc) lấy toàn bộ lượng kim loại thoát ra cho vào dung dịch HCL dư thu được 739,2 ml H2 (đktc) xác định công thức của oxit kim loại đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


CTHH: RxOy
\(n_{H_2}=\dfrac{0,9856}{22,4}=0,044\left(mol\right)\)
PTHH: RxOy + yH2 --to--> xR + yH2O
\(\dfrac{0,044}{y}\)<-0,044--->\(\dfrac{0,044x}{y}\)
=> \(M_{R_xO_y}=x.M_R+16y=\dfrac{2,552}{\dfrac{0,044}{y}}=58y\left(g/mol\right)\)
=> \(M_R=\dfrac{42y}{x}\left(g/mol\right)\) (1)
Gọi hóa trị của R trong hợp chất muối clorua là n
\(n_{H_2}=\dfrac{0,7392}{22,4}=0,033\left(mol\right)\)
PTHH: 2R + 2nHCl --> 2RCln + nH2
\(\dfrac{0,066}{n}\)<------------------0,033
=> \(\dfrac{0,066}{n}=\dfrac{0,044x}{y}\)
=> \(\dfrac{y}{x}=\dfrac{2n}{3}\) (2)
(1)(2) => MR = 28n (g/mol)
- Nếu n = 1 => Loại
- Nếu n = 2 => MR = 56 (g/mol) --> Fe
- Nếu n = 3 => Loại
Vậy R là Fe
\(\dfrac{x}{y}=\dfrac{3}{4}\) => CTHH: Fe3O4

PTHH: AxOy + yCO --to--> xA + yCO2
Có: nCO(dư) + nCO2 = nCO(bd) = \(\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Mà \(\dfrac{28.n_{CO\left(dư\right)}+44.n_{CO_2}}{n_{CO}+n_{CO_2}}=20,4.2=40,8\)
=> nCO2 = 0,048 (mol)
\(n_{A_xO_y}=\dfrac{2,784}{x.M_A+16y}\left(mol\right)\)
AxOy + yCO --to--> xA + yCO2
=> \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{2,784y}{x.M_A+16y}=0,048\left(mol\right)\left(1\right)\\n_A=\dfrac{2,784x}{x.M_A+16y}\left(mol\right)\end{matrix}\right.\)
(1) => \(M_A=\dfrac{42y}{x}=>\dfrac{y}{x}=\dfrac{M_A}{42}\) (2)
PTHH: 2A + 2nHCl --> 2ACln + nH2
=> \(n_{H_2}=\dfrac{1,392xn}{x.M_A+16y}=0,036\left(mol\right)\)
=> \(1,392n=0,036.M_A+\dfrac{0,576y}{x}\) (3)
(2)(3) => MA = 28n
Xét n = 1 => L
Xét n = 2 => MA = 56 (Fe) => \(\dfrac{x}{y}=\dfrac{3}{4}\) => CTHH: Fe3O4
Xin cảm ơn mọi người đã đọc câu hỏi này nhưng em đã nghĩ ra đáp án cho bài tập này rồi ạ

R + H2SO4 → RSO4 + H2
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_R=n_{H_2}=0,25\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{6}{0,25}=24\left(g\right)\)
Vậy R là kim loại magiê Mg
1) Phương trình : R+ H2SO4\(\rightarrow\)RSO4+H2
- nH2=\(\dfrac{5,6}{22,4}=0,25\)(mol)
-Theo phương trình : nR = nH2=0,25 mol
- Ta có : MR = \(\dfrac{m_R}{n_R}=\dfrac{6}{0,25}=24\)(g/mol)
=> R là Magie (Mg)

1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi \(\rightarrow\) (hỗn hợp oxit ) + axit \(\rightarrow\) muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=> \(n_O=\frac{9,6}{16}=0,6mol\)
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 \(\rightarrow\) xM + yH2O (1)
\(n_{H_2}=\frac{985,6}{22,4.1000}=0,044\left(mol\right)\)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl \(\rightarrow\) 2MCln + nH2 (2)
\(n_{H_2}=\frac{739,2}{22,4.1000}=0,033\left(mol\right)\)
(2) => \(\frac{1,848}{M}.n=2.0,033\)
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1) \(\frac{x}{y}=\frac{n_M}{n_{H_2}}=\frac{0,033}{0,044}=\frac{3}{4}\)
=> oxit cần tìm là Fe3O4
1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi ![]() (hỗn hợp oxit ) + axit
(hỗn hợp oxit ) + axit ![]() muối + H2O
muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=> ![]()
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 ![]() xM + yH2O (1)
xM + yH2O (1)
![]()
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl ![]() 2MCln + nH2 (2)
2MCln + nH2 (2)
![]()
(2) => ![]()
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1) ![]()
=> oxit cần tìm là Fe3O4


Ta có bảng sau:
n |
1 |
2 |
3 |
4 |
M |
21 (loại) |
42 (loại) |
63 (loại) |
84 (loại) |
=> loại trường hợp này


Gọi CT oxit là M2Om
Mol H2 TN1=0,06 mol
Mol H2 TN2=0,045 mol
M2Om + mH2→ 2M + mH2O
0,06/m mol<=0,06 mol. =>0,12/m mol
=>0,06(2M+16m)/m=3,48
2M + 2nHCl→ 2MCln + nH2
0,12/m mol. 0,045 mol
⇒⇒0,045.2/n=0,12/m⇒⇒m=8/3; n=2 tm
Thay m=8/3 vào công thức tính m có M=56 FeFe
Oxit là Fe3O4 vì n=8/3

Gọi công thức oxit ban đầu là MxOy.
Có phản ứng khử hoàn toàn oxit MxOy thành kim loại:
![]()
Dẫn khí CO2 sinh ra hấp thụ vào dung dịch Ca(OH)2 dư:
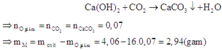
Cần lưu ý: Hóa trị của kim loại M trong oxit ban đầu và hóa trị của M trong sản phẩm của phản ứng giữa M với axit HCl có thể khác nhau.
Do đó ta gọi n là hóa trị của M thể hiện khi phản ứng với axit HCl.
![]()
Áp dụng định luật bào toàn mol electron, ta có:
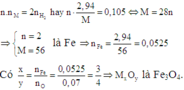
Đáp án D.



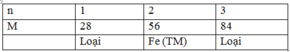
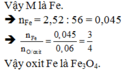
Đặt công thức oxit kim loại là MxOy a (mol)
Ta có: \(O+H_2\rightarrow H_2O\)
nO=ya=nH2(1)=0,044(mol)
moxit=mKL+mO=mKL+16.0,044=2,552(g) ⇒ mKL=1,848(g)
\(M+nHCl\rightarrow MCl_n+\dfrac{n}{2}H_2\)
nM=xa=(2/n).nH2=0,066/n(mol)
\(M_M=\dfrac{1,848}{\dfrac{0,066}{n}}=28n\Rightarrow n=2\Rightarrow M_M=56\left(g/mol\right)\Rightarrow Fe\)
Ta có: \(\dfrac{xa}{ya}=\dfrac{x}{y}=\dfrac{\dfrac{0,066}{2}}{0,044}=\dfrac{3}{4}\)
⇒Fe3O4