Muối cloruacủa kim loại A trong đó A chiếm 31% về KL, KL mol là 47,9. Xác định hóa trị của kim loại A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi công thức của B là R2Ox
Theo đề ra, ta có: 16x = \(\frac{3}{7}.2R\)
Vì R là kim loại mà x là hóa trị
=> x thường nhận các giá trị 1, 2, 3
- Nếu x = 1 => R = 28 => Loại
- Nếu x = 2 => R = 56 => R là sắt ( Fe )
- Nếu x = 3 => R = 84 => Loại
Vậy công thức hóa học của B là FeO

Ta có A có dạng ACln
\(M_A=47,9\)
\(\rightarrow\%_A=\frac{M_A}{M_A+35,5.n}=31\%\rightarrow n=3\)
Muối có dạng ACl3
Hóa trị của A là x; Cl là I
\(\rightarrow x.1=I.3\rightarrow x=III\)

m cation KL ko đổi=4,05g
=>mSO4(2-) =25,65-4,05=21,6g
=>nSO4(2-)=0,225 mol
Mà nSO4(2-)=1/2 n e nhường
=>n e nhường=0,45 mol
Gọi KL là X có hóa trị m
X => X+m + me
0,45/m mol<= 0,45 mol
S+6 +2e => S+4
=>0,45/m.X=4,05=>X=9m=>chọn m=3=>X=27 Al

a)
\(n_{H_2} = \dfrac{3,808}{22,4} = 0,17(mol)\\ \Rightarrow n_{HCl} = 2n_{H_2} = 0,17.2 = 0,34(mol)\)
Bảo toàn khối lượng :
\(m_{muối} = m_{kim\ loại} + m_{HCl} - m_{H_2} = 4 + 0,34.36,5 - 0,17.2 = 16,07(gam)\)
b)
\(n_A = a(mol) \Rightarrow n_{Al} =5a(mol)\\ A + 2HCl \to 2ACl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + H_2\\ n_{H_2} = n_A + \dfrac{3}{2}n_{Al} = a + \dfrac{3}{2}.5a = 0,17\\ \Rightarrow a = 0,02\\ m_{hỗn\ hợp} = 0,02A + 0,02.5.27 = 4\\ \Rightarrow A = 65(Zn)\)
Vậy kim loại hóa trị II cần tìm là Kẽm.

Gọi kim loại cần tìm là M, có hóa trị là n
Công thức muối clorua là MCln
Công thức muối nitrat là M(NO3)n. Có số mol là x
Theo bài ra ta có hệ phương trình :
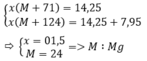

Câu 1 :
Gọi CTHH muối là $M_3(PO_4)_2$
$\%P = \dfrac{31.2}{3M + 95.2}.100\% = 20\%$
$\Rightarrow M = 40(Ca)$
Vậy muối là $Ca_3(PO_4)_2$
Câu 2 :
Gọi CTHH muối là $M_3(PO_4)_2$
$\%M = \dfrac{3M}{3M + 95.2}.100\% = 38,7\%$
$\Rightarrow M = 40(Ca)$
Trong $CaCO_3$, $\%Ca = \dfrac{40}{100}.100\% = 40\%$
Gọi CTHH là AClx ( x là hóa trị của A)
KL mol của Cl là:47,9.\(\dfrac{100-31}{100}=33\)
x=\(\dfrac{33}{35,5}\approx1\)
Vậy A hóa trị 1