Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2= nR= 0.375
--> M<R>= 21/0.375=56: Fe
nFeSO4.nH2O=nFe=0.375
--> 152*0.375+18n*0.375=104,25
-->n=7
--> FeSO4.7H2OnH2= nR= 0.375
--> M<R>= 21/0.375=56: Fe
nFeSO4.nH2O=nFe=0.375
--> 152*0.375+18n*0.375=104,25
-->n=7
--> FeSO4.7H2O

Gọi kim loại hóa trị 2 là A
nH2 = 8.4/22.4=0.375mol
A + H2SO4 -> ASO4 + H2
(mol) 0.375 0.375 0.375 0.375
mH2 = 0.375*2=0.75g
mH2SO4 = 0.375*98=36.75g
Áp dụng định luật bảo toàn khối lượng
mA + mH2SO4 = mASO4 + H2
=> mASO4 = 21 + 36.75 - 0.75 = 57g
MASO4 = m/n = 57/0.375=152
A + 96 =152
-> A = 56 (Fe)
b) gọi CTHH của tinh thể là FeSO4.nH2O
nFeSO4.nH2O = nFeSO4 = 0.375mol
MFeSO4.nH2O = m/n= 104.25/0.375=278
MFeSO4.nH2O = 278
152+ 18n = 278
18n= 126
n= 7
Vậy. CTHH của tinh thể muối hidrat là FeSO4.7H2O

\(Đặt.muối:A_2\left(CO_3\right)_3\\ n_{A_2\left(CO_3\right)_3}=a\left(mol\right)\Rightarrow n_{H_2SO_4}=3a\left(mol\right)\\ m_{ddH_2SO_4}=\dfrac{3a.98.100}{16}=1837,5a\left(g\right)\\ A_2\left(CO_3\right)_3+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3CO_2+3H_2O\\ m_{ddsau}=\left(M_A.2+180\right).a+1837,5a-44a.3=1885,5a+2M_A.a\left(g\right)\\ Vì:C\%_{dd.muối.sunfat}=16\%\\ \Leftrightarrow\dfrac{\left(2M_A+288\right).a}{\left(1885,5+2M_A\right).a}.100\%=16\%\\ \Leftrightarrow M_A=8,14\left(loại\right)\)
Không có kim loại thỏa

a) PTHH : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) \(n_{H_2SO_4}=C_MV=1,2\cdot0,5=0,6\left(mol\right)\)
PTHH : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,6 0,6 0,6
\(\Rightarrow m_{FeSO_4}=n_{FeSO_4}M_{FeSO_4}=0,6\cdot152=91,2\left(g\right)\)
c) Từ câu b \(\Rightarrow n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow V_{H_2}=n_{H_2}.22,4=0,6\cdot22,4=13,44\left(l\right)\)
d) PTHH : \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,6 0,6
\(\Rightarrow m_{Cu}=n_{Cu}M_{Cu}=0,6\cdot64=38,4\left(g\right)\)
a)\(PTHH:Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\)
b)Đổi 500ml = 0,5l
Số mol của H2SO4 là:
\(C_{MH_2SO_4}=\dfrac{n_{H_2SO_4}}{V_{H_2SO_{\text{4 }}}}\Rightarrow n_{H_2SO_4}=C_{MH_2SO_4}.V_{H_2SO_4}=1,2.0,5=0,6\left(mol\right)\)
\(PTHH:Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\)
Tỉ lệ : 1 1 1 1 (mol)
Số mol : 0,6 0,6 0,6 0,6(mol)
Khối lượng sắt(II)sunfat thu được là:
\(m_{FeSO_4}=n_{FeSO_4}.M_{FeSO_{\text{4 }}}=0,6.152=91,2\left(g\right)\)
c) Thể tích khí H2 thoát ra là:
\(V_{H_2}=n_{H_2}.22,4=0,6.22,4=13,44\left(l\right)\)
d)\(PTHH:CuO+H_2\xrightarrow[]{t^0}Cu+H_2O\)
tỉ lệ :1 1 1 1 (mol)
số mol :0,6 0,6 0,6 0,6 (mol)
Khối lượng CuO điều chế được là:
\(m_{CuO}=n_{CuO}.M_{CuO}=0,6.80=48\left(g\right)\)

Đáp án D
![]()
chứa H 2 và NO với số mol
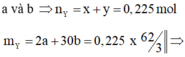
Giải hệ có: a = 0,75 mol; b = 0,15 mol
![]()
![]()
Bảo toàn nguyên tố Nitơ:![]()
Bảo toàn nguyên tố Fe:
![]()
Bảo toàn điện tích + nguyên tố Al:
![]()
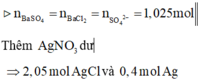
=> x = 567,2 (g) => x+ m = 52 + 567,2 = 628,2 (g)

*Gọi kim loại hóa trị II là A
PTHH : A + H2SO4 \(\rightarrow\) ASO4 + H2
Có : nH2 = 8,4/22,4 = 0,375(mol)
Theo PT \(\Rightarrow\) nA = nH2 = 0,375(mol)
\(\Rightarrow\) MA = m/n = 21/0,375 = 56 (g)
\(\Rightarrow\) A là kim loại Sắt (Fe)
\(\Rightarrow\) muối sunfat của kim loại đó là FeSO4
*Gọi CTHH dạng TQ của hidrat hóa là FeSO4.xH2O
Theo PT \(\Rightarrow\) nFeSO4 = nH2 = 0,375(mol)
\(\Rightarrow\) nFeSO4.xH2O = 0,375(mol)
\(\Rightarrow\) MFeSO4.xH2O = m/n = 104,25/0,375 = 278 (g)
hay 56 + 32+ 4.16 + x . 18= 278
\(\Rightarrow\) x = 7
Vậy CTHH của hidrat hóa là FeSO4.7H2O