: Chất dùng để điều chế clo trong phòng thí nghiệm là
A. mangan đioxit và axit clohiđric đặc.
B. mangan đioxit và axit sunfuric đặc.
C. mangan đioxit và axit nitric đặc.
D. mangan đioxit và muối natri clorua.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.S + O2 --(t\(^o\))--> SO2
SO2 + 1/2O2 --(t\(^o,xtV2O5\))--> SO3
SO3 + H2O -> H2SO4
b.MnO2 + 4HCl --(t\(^o\))--> MnCl2 +Cl2 + 2H2O
c.2NaOH + Cl2 -> NaCl + NaClO + H2O

Chọn đáp án A
n M n O 2 = 69 , 6 87 =0,8 (mol); n N a O H = 0,5.4 = 2 (mol)
M n O 2 + 4HCl → M n C l 2 + C l 2 + 2 H 2 O
0,8 0,8 (mol)
C l 2 + 2NaOH → NaCl + NaClO + H 2 O
0,8 1,6 0,8 (mol)
C M N a C l = 0 , 8 0 , 5 = 1,6(M); C M ( N a O H d ư ) = 2 - 1 ; 6 0 ; 5 = 0,8(M)

mình có 3 pthh nek
đầu tiên là điện phân nacl
NaCl+h20 ----> Naoh +cl2 +h2
KMnO4 + Hcl ------> kcl +mncl2 +cl2 +h20
MnO2+Hcl------> Mncl2+cl2+h20![]()

Đáp án C

Trong 5 khí trên thì có 4 khí phản ứng được với dung dịch KOH là Cl2, H2S, CO2 và SO2

Đáp án C
Phương trình phản ứng :
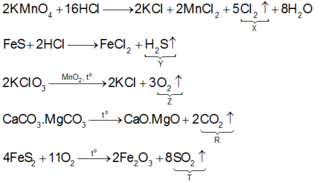
Trong 5 khí trên thì có 4 khí phản ứng được với dung dịch KOH là Cl 2 , H 2 S , CO 2 và SO 2 .

nNaOH = 0,5 x 4 = 2 mol
a) Phương trình hóa học của phản ứng :
MnO2 + 4 HCl → MnCl2 + Cl2 +2H2O
0,8 mol 0,8mol 0,8 mol
Cl2 + 2NaOH → NaCl + NaClO + H2O
0,8 mol → 1,6 mol 0,8mol 0,8mol
b) Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM(NaCl) = = CM(NaClO) =
= 1,6 mol/l
CM(NaOH)dư = = 0,8 mol/l
MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
Ta có : nMnO2=69,6/(55+16.2)=0,8 mol
Theo ptpu: nCl2=nMnO2=0,8 mol
nNaOH=0,5.4=2 mol
Cho Cl2 vào dung dịch NaOH
2NaOH + Cl2 -> NaCl + NaClO + H2O
Vì nNaOH > 2nCl2 nên NaOH dư
-> nNaOH phản ứng=2nCl2=0,8.2=1,6 mol
-> nNaOH dư=2-1,6=0,4 mol
nNaCl=nNaClO=nCl2=0,8 mol
->CM NaOH dư=0,4/0,5=0,8M
CM NaCl= CM NaClO=0,8/0,5=1,6M

L tan trong H2O tác dụng với MnO2 sinh ra khí màu lục nhạt → M là Cl2.
Cl2 phản ứng với Na nóng chảy tạo ra NaCl → chất K là NaCl.
L là khí HCl.
A