Cho 8g MgO tác dụng hoàn toàn với 146g dung dịch HCl.
a- Viết PTHH
b- Tính nồng độ % dung dịch HCl đã dùng.
c- Tính nồng độ % dung dịch thu được sau phản ứng.
Cho : Mg = 24 O = 16 H = 1 Cl = 35,5
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{ZnO}=\dfrac{16,2}{81}=0,2\left(mol\right)\)
a, PT: \(ZnO+2HCl\rightarrow ZnCl_2+H_2O\)
______0,2_____0,4____0,2 (mol)
b, \(m_{HCl}=0,4.36,5=14,6\left(g\right)\Rightarrow m_{ddHCl}=\dfrac{14,6}{10\%}=146\left(g\right)\)
c, \(C\%_{ZnCl_2}=\dfrac{0,2.136}{16,2+146}.100\%\approx16,77\%\)
Bạn tham khảo nhé!

Câu 3 :
\(n_{MgO}=\dfrac{8}{40}=0,2\left(mol\right)\)
1) Pt : \(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,2 0,4 0,2
\(n_{MgCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{MgCl2}=0,2.136=27,2\left(g\right)\)
2) \(n_{HCl}=\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
\(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(m_{ddHCl}=\dfrac{14,6.100}{20}=73\left(g\right)\)
Chúc bạn học tốt
Mình xin lỗi bạn nhé , bạn sửa lại giúp mình chỗ :
\(m_{MgCl2}=0,2.95=19\left(g\right)\)

a, Ta có: \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{HCl}=2n_{Mg}=0,4\left(mol\right)\Rightarrow C\%_{HCl}=\dfrac{0,4.36,5}{100}.100\%=14,6\%\)
Để giải bài toán này, ta cần viết phương trình phản ứng giữa Mg và HCl:
$$\text{Mg} + 2\text{HCl} \rightarrow \text{MgCl}2 + \text{H}2$$
Theo đó, 1 mol Mg tác dụng với 2 mol HCl để tạo ra 1 mol H2. Ta có thể tính số mol Mg trong 4,8g Mg như sau:
$$n{\text{Mg}} = \frac{m{\text{Mg}}}{M_{\text{Mg}}} = \frac{4,8}{24} = 0,2 \text{mol}$$
Vì 1 mol Mg tác dụng với 2 mol HCl để tạo ra 1 mol H2, nên số mol HCl cần để tác dụng với 0,2 mol Mg là 0,4 mol. Từ đó, ta có thể tính khối lượng HCl cần dùng như sau:
$$m_{\text{HCl}} = n_{\text{HCl}} \times M_{\text{HCl}} = 0,4 \times 36,5 = 14,6 \text{g}$$
Vậy, dung dịch HCl có nồng độ $c = \frac{m_{\text{HCl}}}{V_{\text{HCl}}}$, trong đó $V_{\text{HCl}}$ là thể tích dung dịch HCl đã dùng. Để tính thể tích HCl đã dùng, ta cần biết nồng độ của dung dịch axit HCl đã dùng. Ta có thể tính nồng độ % của dung dịch axit HCl như sau:
$$\text{nồng độ %} = \frac{m_{\text{HCl}}}{m_{\text{dung dịch}}} \times 100%$$
Trong đó, $m_{\text{dung dịch}}$ là khối lượng của dung dịch HCl đã dùng. Từ đó, ta có thể tính được thể tích dung dịch HCl đã dùng và thể tích H2 thoát ra ở đktc như sau:
\begin{align*}
m_{\text{dung dịch}} &= \frac{m_{\text{HCl}}}{\text{nồng độ %}} = \frac{14,6}{36,5} \times 100% = 40\text{g} \
V_{\text{HCl}} &= \frac{m_{\text{HCl}}}{c_{\text{HCl}}} = \frac{14,6}{0,365} = 40\text{mL} \
V_{\text{H}2} &= n{\text{H}2} \times V{\text{m}} = 0,1 \times 24,45 = 2,445\text{L}
\end{align*}
Vậy, thể tích H2 thoát ra ở đktc là 2,445 L.

a). 2Al + 6HCl → 2AlCl3 + 3H2
2 6 2 3
0,1 0,3 0,1
nAl = \(\dfrac{2,7}{27}\)= 0,1(mol)
b). nAlCl3=\(\dfrac{0,1.2}{2}\)=0,1(mol)
⇒mAlCl3= n.M= 0,1 . 133,5= 13,35(g)
c). 200ml= 0,2l
nHCl= \(\dfrac{0,1.6}{2}\)=0,3(mol)
→CM= \(\dfrac{n}{V}\)= \(\dfrac{0,3}{0,2}\)= 1,5M

PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2}=n_{Zn}=0,2\left(mol\right)\\n_{HCl}=2n_{Zn}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{0,4}{0,2}=2\left(M\right)\)

\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
1 1 1 1
0,3 0,3 0,3 0,3
\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
a). \(n_{H2}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
⇒\(V_{H2}=n.22,4=0,3.22,4=6,72\left(l\right)\)
b). \(80ml=0,08l\)
\(n_{H2SO4}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
→\(C_M=\dfrac{n}{V}=\dfrac{0,3}{0,08}=3,75\left(M\right)\)
c). \(n_{MgSO4}=\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
\(V_{MgSO4}=n.22,4=0,3.22,4=6,72\left(l\right)\)
→\(C_M=\dfrac{n}{V}=\dfrac{0,3}{6,72}=0,04\left(M\right)\)
d). \(MgSO_4+Ba\left(OH\right)_2\rightarrow Mg\left(OH\right)_2+BaSO_4\downarrow\)
1 1 1 1
0,3 0,3 0,3
\(n_{BaSO4\uparrow}=\dfrac{0,3.1}{1}\)=0,3(mol)
→\(m_{BaSO4\downarrow}=n.M=0,3.233=69,9\left(g\right)\)
\(n_{Ba\left(OH\right)_2}=\dfrac{0,3.1}{1}\)=0,3(mol)
\(\rightarrow V_{ddBa\left(OH\right)_2}=\dfrac{n}{C_M}=\dfrac{0,3}{1,6}=0,1875\left(l\right)\)

PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
Ta có: \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=0,2\left(mol\right)\\n_{H_2}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{HCl}=\dfrac{0,2\cdot36,5}{200}\cdot100\%=3,65\%\\V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\end{matrix}\right.\)

\(a/\\MgO+2HCl \to MgCl_2+H_2O\\ n_{MgO}=\frac{8}{40}=0,2(mol)\\ b/\\ n_{HCl}=0,2.2=0,4(mol)\\ CM_{HCl}=\frac{0,4}{0,2}=2M\)

\(n_{Zn}=\dfrac{13}{65}=0,2(mol)\\ a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,n_{HCl}=0,4(mol)\\ \Rightarrow C\%_{HCl}=\dfrac{0,4.36,5}{100}.100\%=14,6\%\\ c,n_{ZnCl_2}=n_{H_2}=0,2(mol)\\ \Rightarrow m_{ZnCl_2}=0,2.136=27,2(g)\\ \Rightarrow C\%_{ZnCl_2}=\dfrac{27,2}{13+100-0,2.2}.100\%\approx 24,16\%\)
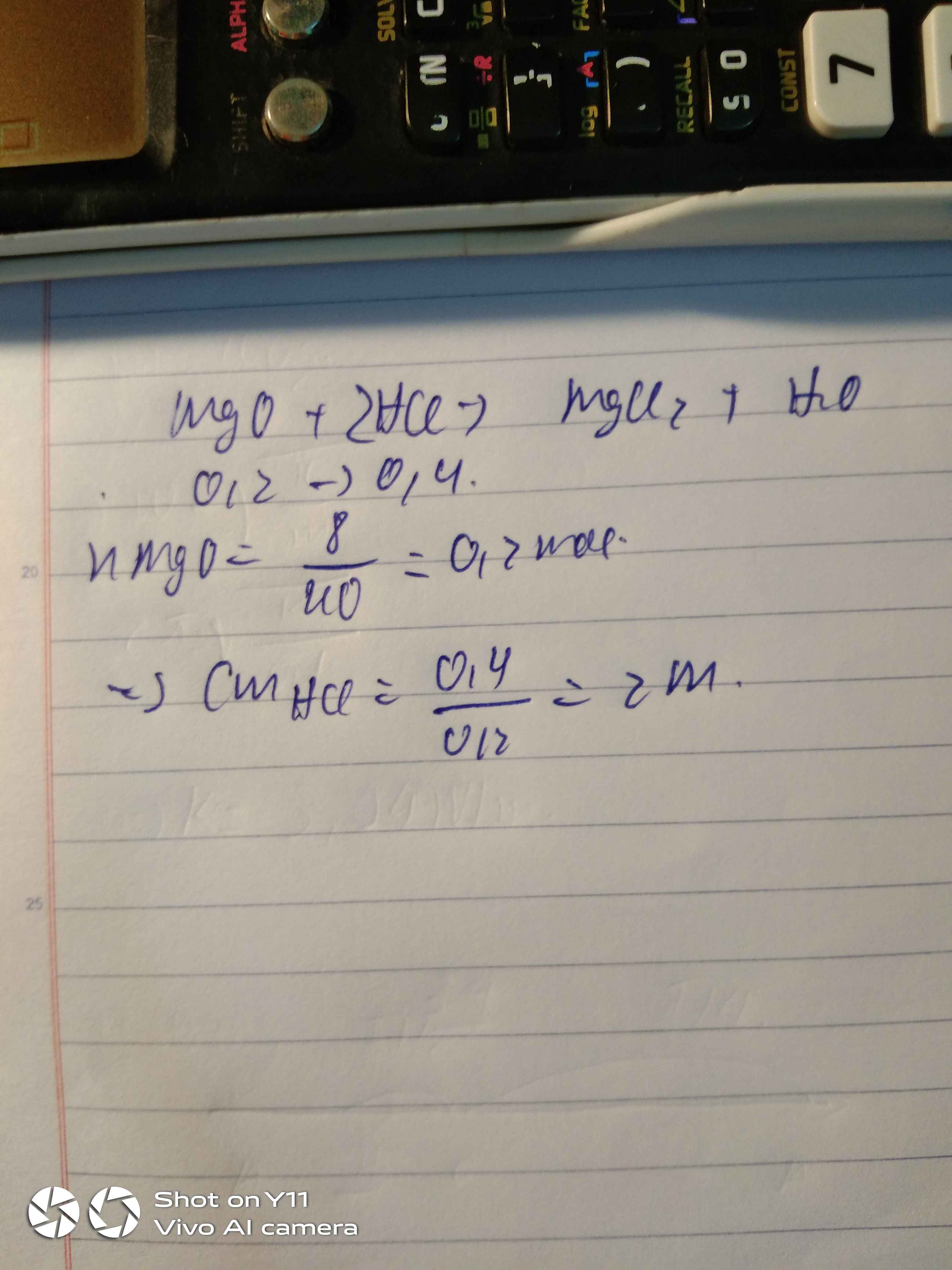
nMgO = 8/40=0,2(mol)
a) PTHH: MgO +2 HCl -> MgCl2 + H2O
0,2________0,4________0,2(mol)
b) mHCl= 0,4.36,5=14,6(g)
=>C%ddHCl= (14,6/146).100=10%
c) mddMgCl2= 8+ 146= 154(g)
mMgCl2= 0,2.95=19(g)
=>C%ddMgCl2= (19/154).100=12,338%
số mol của magie oxit
nMgO = \(\dfrac{m_{Mg}}{M_{Mg}}=\dfrac{8}{40}=0,2\left(mol\right)\)
a) MgO + 2HCl → MgCl2 + H2O\(|\)
1 2 1 1
0,2 0,4 0,2
b) Số mol của axit clohidric
nHCl = \(\dfrac{0,2.2}{1}=0,4\left(mol\right)\)
Khối lượng của axit clohidric
mHCl = nHCl . MHCl
= 0,4. 36,5
= 14,6 (g)
Nồng độ phần trăm của dung dịch axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{14,6.100}{146}=10\)0/0
c) Số mol của magie clorua
nMgCl2 = \(\dfrac{0,4.1}{2}=0,2\left(mol\right)\)
Khối lượng của magie clorua
mMgCl2 = nMgCl2 . MMgCl2
= 0,2. 95
= 19 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mMgO + mHCl
= 8 + 146
= 154 (g)
Nồng độ phần trăm của magie clorua
C0/0MgCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{19.100}{154}=12,34\)0/0
Chúc bạn học tốt