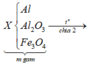
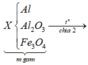
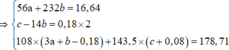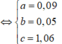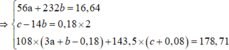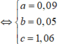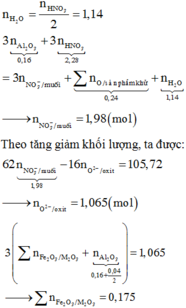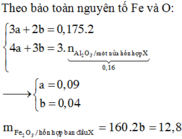1/cho 10,8g al vào m g hh X gồm CuO và Fe3O4 vào bình chân không rồi nung nóng thu được hh rắn Y. Chia Y làm 2 phần bằng nhau
P1 cho tác dụng NaOH dư thu được 0,06 mol H2 và 18,08g chất rắn ko tan
P2 cho tác dụng hết với dd HNO3 dư thu được 106,16g muối và thoát ra 0,18 mol khí NO(duy nhất). KL Fe3O4 trong X?????
2/ hòa tan hoàn toàn FeS và Fe3O4 trong m g ddHNO3 50% thu được 2,688 lít NO2(đkc sản phấm duy nhất N+5). Dung dịch thu được phản ứng vừa đủ với 240ml dd NaOH 2M, lọc kết tủa nung đến ko đổi thu được 8 g rắn. Tìm m??
mn giúp e vs
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: 3Fe3O4 + 8Al --to--> 4Al2O3 + 9Fe
=> \(\dfrac{n_{Fe}}{n_{Al_2O_3}}=\dfrac{9}{4}\)
P1: Gọi (nAl; nFe; nAl2O3) = (a;b;c)
PTHH: 2Al + 2NaOH + 2H2O --> 2NaAlO2 + 3H2
0,04<---------------------------------0,06
=> a = 0,04 (mol)
Chất rắn không tan là Fe
\(b=\dfrac{20,16}{56}=0,36\left(mol\right)\)
Có: \(\dfrac{n_{Fe}}{n_{Al_2O_3}}=\dfrac{b}{c}=\dfrac{9}{4}\) => c = 0,16 (mol)
P2: Gọi (nAl; nFe; nAl2O3) = (ak;bk;ck)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
ak------------------>1,5ak
Fe + 2HCl --> FeCl2 + H2
bk------------------>bk
=> 1,5ak + bk = 0,63
=> k = 1,5
Bảo toàn Fe: \(n_{Fe_3O_4\left(X\right)}=\dfrac{b+bk}{3}=\dfrac{0,36+0,36.1,5}{3}=0,3\left(mol\right)\)
Bảo toàn Al: \(n_{Al\left(X\right)}=a+2c+ak+2ck=0,9\left(mol\right)\)
\(\left\{{}\begin{matrix}\%m_{Fe_3O_4}=\dfrac{0,3.232}{0,3.232+0,9.27}.100\%=74,12\%\\\%m_{Al}=\dfrac{0,9.27}{0,3.232+0,9.27}.100\%=25,88\%\end{matrix}\right.\)

Giải thích:
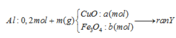
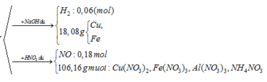
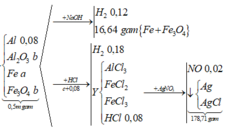
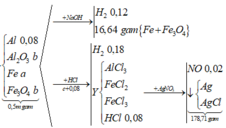
Coi trong mỗi phần có 0,2 mol Al
- Rắn Y + NaOH → 0,06 nH2
BT: e => nAl DƯ = 2/3 nH2 = 2/3. 0,06 = 0,04 ( mol)
BTNT: Al => nAl2O3 = ½ ( nAlbđ – nAl dư) = ½ ( 0,2 – 0,04) = 0,08 (mol)
BTKL: m = mFe, Cu + mO = 18,08 + 0,08.3.16 = 21,92 (g)
=> 80a + 232b = 21,92 (1)
- Rắn Y + HNO3
Sau tất cả quá trình ta có: Al → Al+3 ; Fe+8/3 → Fe+3, N+5 → N+2; N+5→ N-3
BT e ta có: 3nAl + nFe3O4 = 3nNO + 8nNH4NO3
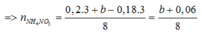
mmuối = mAl(NO3)3 + mCu(NO3)3 + mFe(NO3)3 + mNH4NO3
=>213.0,2 +188a + 242.3b + 80 ( b+0,06)/8 = 106,12 (2)
Từ (1) và (2) => a = 0,1 và b = 0,06
=> mFe3O4 = 232.2b = 232.2.0,1= 27,84 (g) ( Vì hỗn hợp ban đầu nên phải nhân đôi số liệu)
Đáp án A

Đáp án C
Đồng nhất số liệu bằng cách nhân đôi giả thiết ở 2 phần
- Giải phần 1: chỉ có Al tạo khí: 2Al + 2NaOH 2NaAlO2 + 3H2 → đọc ra từ 0,12 mol H2 có 0,08 mol Al; mà
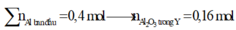
ó Phản ứng nhiệt nhôm:
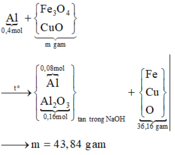
Giả sử hỗn hợp X có x mol Fe3O4 và y mol CuO ta có: 233x + 80y = 43,84 gam (1)
- Giải phần 2: vì dùng dư HNO3 nên hỗn hợp đầu hay Y tác dụng đều cho cùng sản phẩm.
ó Rõ hơn, ta có sơ đồ quá trình: 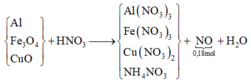
Bảo toàn electron ta có:
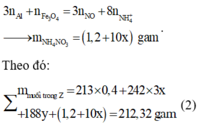
Giải hệ các phương trình (1) và (2) ta được: x = 0,12 mol và y = 0,2 mol.
Vậy, m gam X gồm 27,84 gam Fe3O4 và 16,0 gam CuO.